Questões do Enem Comentadas sobre química
Foram encontradas 452 questões
A propriedade que o metal associado ao cobre deve apresentar para impedir a formação de zinabre nas moedas é, em relação ao cobre,
- Frascos 1, 3 e 5 contêm líquidos miscíveis entre si; - Frascos 2 e 4 contêm líquidos miscíveis entre si; - Frascos 3 e 4 contêm líquidos não inflamáveis.
Com base nesses resultados, pode-se concluir que a água está contida no frasco
Esse processo de deterioração ocorre em função da
Qual teste listado permite detectar a irregularidade descrita?
O processo descrito para a purificação da água é denominado
Qual é o valor mais próximo para o volume de solução de Ca(Oh)2, em mL, que deve estar contido em cada ampola do kit para garantir a determinação da regularidade da amostra testada?
PlATÃO, Timeu (c. 360 a.C.).
Buscando compreender a diversidade de formas e substâncias que vemos no mundo, diversas culturas da Antiguidade elaboraram a noção de “quatro elementos” fundamentais, que seriam terra, água, ar e fogo. Essa visão de mundo prevaleceu até o início da Era Moderna, quando foi suplantada diante das descobertas da química e da física.
PlATÃO. Timeu-Crítias. Coimbra: CECh, 2011.
Do ponto de vista da ciência moderna, a descrição dos “quatro elementos” feita por Platão corresponde ao conceito de
Um dos parâmetros de controle de qualidade de polpas de frutas destinadas ao consumo como bebida é a acidez total expressa em ácido cítrico, que corresponde à massa dessa substância em 100 gramas de polpa de fruta. O ácido cítrico é uma molécula orgânica que apresenta três hidrogênios ionizáveis (ácido triprótico) e massa molar 192 g mol−1. O quadro indica o valor mínimo desse parâmetro de qualidade para polpas comerciais de algumas frutas.
Polpa de fruta Valor mínimo da acidez total
expressa em ácido cítrico
(g/100 g)
Acerola 0,8
Caju 0,3
Cupuaçu 1,5
Graviola 0,6
Maracujá 2,5
A acidez total expressa em ácido cítrico de uma amostra comercial de polpa de fruta foi determinada. No procedimento, adicionou-se água destilada a 2,2 g da amostra e, após a solubilização do ácido cítrico, o sólido remanescente foi filtrado. A solução obtida foi titulada com solução de hidróxido de sódio 0,01 mol L−1, em que se consumiram 24 mL da solução básica (titulante).
BRASIL. Ministério da Agricultura e do Abastecimento. Instrução normativa n. 1, de 7 de janeiro de 2000. Disponível em: www.agricultura.gov.br. Acesso em: 9 maio 2019 (adaptado).
Entre as listadas, a amostra analisada pode ser de qual
polpa de fruta?
Um experimento simples, que pode ser realizado com materiais encontrados em casa, é realizado da seguinte forma: adiciona-se um volume de etanol em um copo de vidro e, em seguida, uma folha de papel. Com o passar do tempo, observa-se um comportamento peculiar: o etanol se desloca sobre a superfície do papel, superando a gravidade que o atrai no sentido oposto, como mostra a imagem. Para parte dos estudantes, isso ocorre por causa da absorção do líquido pelo papel.
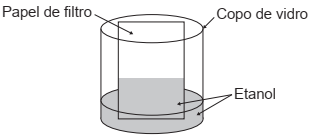
Do ponto de vista científico, o que explica o movimento
do líquido é a
Uma das técnicas de reciclagem química do polímero PET [poli(tereftalato de etileno)] gera o tereftalato de metila e o etanodiol, conforme o esquema de reação, e ocorre por meio de uma reação de transesterificação.
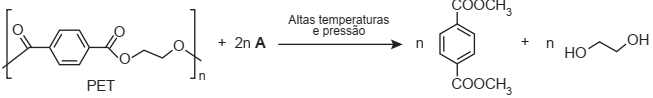
O composto A, representado no esquema de reação, é o
Glicólise é um processo que ocorre nas células, convertendo glicose em piruvato. Durante a prática de exercícios físicos que demandam grande quantidade de esforço, a glicose é completamente oxidada na presença de O2. Entretanto, em alguns casos, as células musculares podem sofrer um déficit de O2 e a glicose ser convertida em duas moléculas de ácido lático. As equações termoquímicas para a combustão da glicose e do ácido lático são, respectivamente, mostradas a seguir:
C6H12O6 (s) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (l) ∆cH = −2 800 kJ
CH3CH(OH)COOH (s) + 3 O2 (g) → 3 CO2 (g) + 3 H2O (l) ∆cH = −1 344 kJ
O processo anaeróbico é menos vantajoso energeticamente porque
Estudos mostram o desenvolvimento de biochips utilizados para auxiliar o diagnóstico de diabetes melito, doença evidenciada pelo excesso de glicose no organismo. O teste é simples e consiste em duas reações sequenciais na superfície do biochip, entre a amostra de soro sanguíneo do paciente, enzimas específicas e reagente (iodeto de potássio, KI), conforme mostrado na imagem.
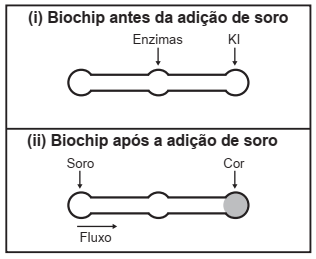
Após a adição de soro sanguíneo, o fluxo desloca- -se espontaneamente da esquerda para a direita (ii) promovendo reações sequenciais, conforme as equações 1 e 2. Na primeira, há conversão de glicose do sangue em ácido glucônico, gerando peróxido de hidrogênio:
Equação 1
C6H12O6 (aq) + O2 (g) + H2O (l)  C6H12O7 (aq) + H2O2 (aq)
C6H12O7 (aq) + H2O2 (aq)
Na segunda, o peróxido de hidrogênio reage com íons iodeto gerando o íon tri-iodeto, água e oxigênio.
Equação 2
2 H2O2 (aq) + 3 l− (aq) → I3− (aq) + 2 H2O (I) + O2 (g)
GARCIA, P. T. et al. A Handheld Stamping Process to Fabricate Microfluidic Paper-Based Analytical Devices with Chemically Modified Surface for Clinical Assays. RSC Advances, v. 4, 13 ago. 2014 (adaptado).
O tipo de reação que ocorre na superfície do biochip,
nas duas reações do processo, é
Por terem camada de valência completa, alta energia de ionização e afinidade eletrônica praticamente nula, considerou-se por muito tempo que os gases nobres não formariam compostos químicos. Porém, em 1962, foi realizada com sucesso a reação entre o xenônio (camada de valência 5s25p6) e o hexafluoreto de platina e, desde então, mais compostos novos de gases nobres vêm sendo sintetizados. Tais compostos demonstram que não se pode aceitar acriticamente a regra do octeto, na qual se considera que, numa ligação química, os átomos tendem a adquirir estabilidade assumindo a configuração eletrônica de gás nobre. Dentre os compostos conhecidos, um dos mais estáveis é o difluoreto de xenônio, no qual dois átomos do halogênio flúor (camada de valência 2s22p5) se ligam covalentemente ao átomo de gás nobre para ficarem com oito elétrons de valência.
Ao se escrever a fórmula de Lewis do composto de
xenônio citado, quantos elétrons na camada de valência
haverá no átomo do gás nobre?
Um teste de laboratório permite identificar alguns cátions metálicos ao introduzir uma pequena quantidade do material de interesse em uma chama de bico de Bunsen para, em seguida, observar a cor da luz emitida.
A cor observada é proveniente da emissão de radiação eletromagnética ao ocorrer a
Grupos de pesquisa em todo o mundo vêm buscando soluções inovadoras, visando a produção de dispositivos para a geração de energia elétrica. Dentre eles, pode-se destacar as baterias de zinco-ar, que combinam o oxigênio atmosférico e o metal zinco em um eletrólito aquoso de caráter alcalino. O esquema de funcionamento da bateria zinco-ar está apresentado na figura.
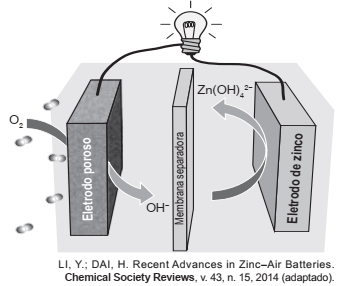
No funcionamento da bateria, a espécie química formada
no ânodo é
Os hidrocarbonetos são moléculas orgânicas com uma série de aplicações industriais. Por exemplo, eles estão presentes em grande quantidade nas diversas frações do petróleo e normalmente são separados por destilação fracionada, com base em suas temperaturas de ebulição. O quadro apresenta as principais frações obtidas na destilação do petróleo em diferentes faixas de temperaturas.
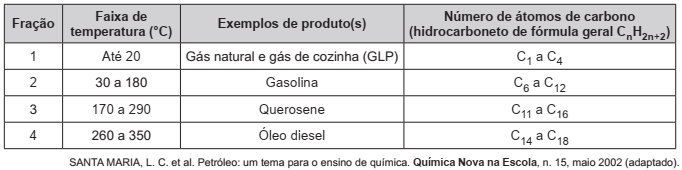
Na fração 4, a separação dos compostos ocorre em temperaturas mais elevadas porque
A utilização de corantes na indústria de alimentos é bastante difundida e a escolha por corantes naturais vem sendo mais explorada por diversas razões. A seguir são mostradas três estruturas de corantes naturais.
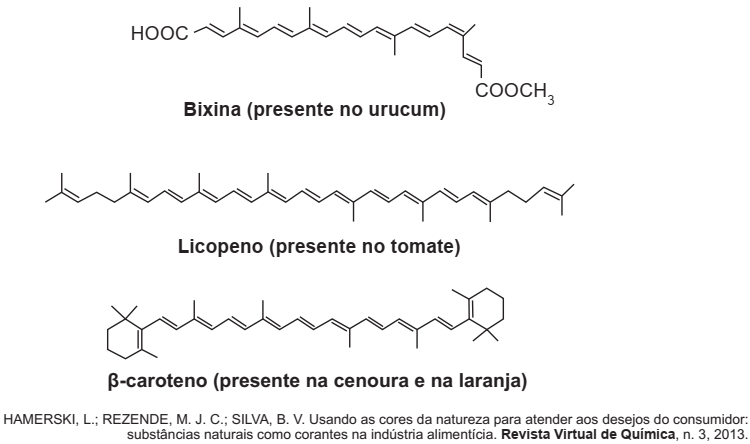
A propriedade comum às estruturas que confere cor a esses compostos é a presença de
O odor que permanece nas mãos após o contato com alho pode ser eliminado pela utilização de um “sabonete de aço inoxidável”, constituído de aço inox (74%), cromo e níquel. A principal vantagem desse “sabonete” é que ele não se desgasta com o uso. Considere que a principal substância responsável pelo odor de alho é a alicina (estrutura I) e que, para que o odor seja eliminado, ela seja transformada na estrutura II.
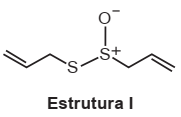
CH2 ═ CH — CH2 — S — S — CH2 — CH ═ CH2
Estrutura II
Para realizar o desentupimento de tubulações de esgotos residenciais, é utilizada uma mistura sólida comercial que contém hidróxido de sódio (NaOH) e outra espécie química pulverizada. Quando é adicionada água a essa mistura, ocorre uma reação que libera gás hidrogênio e energia na forma de calor, aumentando a eficiência do processo de desentupimento. Considere os potenciais padrão de redução (Eo) da água e de outras espécies em meio básico, expressos no quadro.
Semirreação de redução Eo (V)
2 H2O + 2 e− → H2 + 2 OH− −0,83
Co(OH)2 + 2 e− → Co + 2 OH− −0,73
Cu(OH)2 + 2 e− → Cu + 2 OH− −0,22
PbO + H2O + 2 e− → Pb + 2 OH− −0,58
Al(OH)4− + 3 e− → Al + 4 OH− −2,33
Fe(OH)2 + 2 e− → Fe + 2 OH− −0,88
Qual é a outra espécie que está presente na composição
da mistura sólida comercial para aumentar sua eficiência?
Em 1808, Dalton publicou o seu famoso livro intitulado Um novo sistema de filosofia química (do original A New System of Chemical Philosophy), no qual continha os cinco postulados que serviam como alicerce da primeira teoria atômica da matéria fundamentada no método científico. Esses postulados são numerados a seguir:
1. A matéria é constituída de átomos indivisíveis.
2. Todos os átomos de um dado elemento químico são idênticos em massa e em todas as outras propriedades.
3. Diferentes elementos químicos têm diferentes tipos de átomos; em particular, seus átomos têm diferentes massas.
4. Os átomos são indestrutíveis e nas reações químicas mantêm suas identidades.
5. Átomos de elementos combinam com átomos de outros elementos em proporções de números inteiros pequenos para formar compostos.
Após o modelo de Dalton, outros modelos baseados em outros dados experimentais evidenciaram, entre outras coisas, a natureza elétrica da matéria, a composição e organização do átomo e a quantização da energia no modelo atômico.
OXTOBY, D. W.; GILLIS, H. P.; BUTLER, L. J. Principles of Modern Chemistry. Boston: Cengage Learning, 2012 (adaptado).
Com base no modelo atual que descreve o átomo, qual dos postulados de Dalton ainda é considerado correto?