Questões Militares
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 98 questões
O trabalho líquido, em kJ, e a eficiência térmica, em %, estão indicados de forma correta, respectivamente, em
PROCESSOS (1) Isobárico (2) Reversível (3) Adiabático (4) Isotérmico (5) Irreversível (6) Isovolumétrico
CARACTERÍSTICAS ( ) Temperatura constante. ( ) Pressão constante. ( ) Volume constante. ( ) O calor não atravessa as fronteiras do sistema. ( ) O estado inicial do sistema envolvido não pode ser restaurado sem efeitos mensuráveis no sistema e na sua vizinhança (processo ideal). ( ) O estado inicial do sistema envolvido não pode ser restaurado sem efeitos mensuráveis no sistema e na sua vizinhança (processo real).
A sequência correta dessa associação é
( ) Corresponde à parte da termologia (física) que estuda os fenômenos relacionados com trabalho, energia, calor e entropia, e as leis que governam os processos de conversão de energia. ( ) É o ramo da física que se dedica ao estudo das relações entre calor e as restantes formas de energia. ( ) Pode ser utilizada para a análise de diversos processos da engenharia que ocorrem em equipamentos industriais. ( ) A primeira lei da termodinâmica diz que a energia não pode ser criada ou destruída; só se pode mudá-la de uma forma para a outra. ( ) A eficiência térmica de processos reversíveis é sempre menor que a eficiência térmica de processos irreversíveis entre os dois mesmos reservatórios térmicos.
De acordo com as afirmações, a sequência correta é
No gráfico a seguir, são fornecidos dados da variação do coeficiente de correlação generalizada para o metano como uma função da pressão e da temperatura reduzidas.
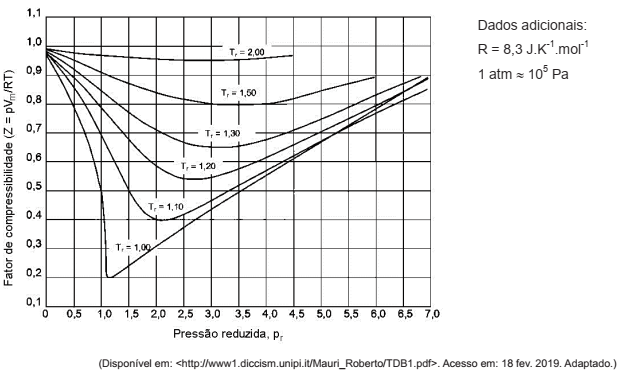
Sabendo-se que a pressão crítica do metano é pc = 45atm, a temperatura crítica é Tc = 190K e que a entalpia
de combustão do CH4
é igual a - 890kJ.mol-1, a vazão volumétrica com que o metano deve ser alimentado
na caldeira é igual a
Uma central termoelétrica, capaz de gerar 50 MW de potência, opera a uma eficiência térmica máxima de 40%.
A taxa de energia dissipada para o ambiente é
Na figura a seguir, é apresentado o diagrama de equilíbrio para sistema SO2(g) – H2O(l), no qual é expressa a solubilidade do dióxido de enxofre na água como uma função da pressão do gás e da temperatura do sistema.
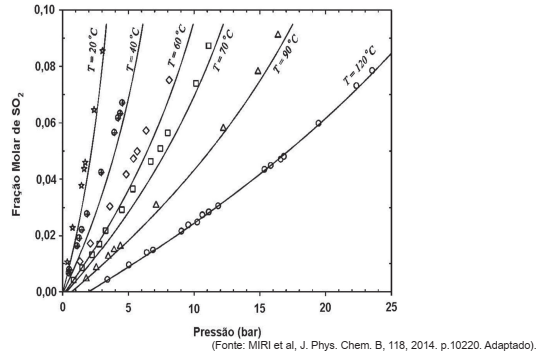
Com base nessa figura, avalie o que se afirma.
I. O aumento da pressão exercida pelo gás favorece a absorção do SO2 (g) pela água.
II. O aumento da temperatura aumenta a capacidade de absorção do SO2 (g) pelo solvente.
III. Na temperatura T = 20° , a absorção ocorre mais rapidamente que à temperatura T = 120° .
Está correto apenas o que se afirma em
Deseja-se fundir 115 g de sódio metálico, inicialmente a 291 K e 1 bar, sendo a energia de transição de fase, à temperatura de transição e 1 bar, igual a 2,6 kJ.mol-1, conforme indicado a seguir.

Sabendo-se que a massa molar do sódio metálico é igual a 23,0 g.mol-1 e considerando-se a capacidade
calorífica molar do sódio metálico constante no intervalo de temperatura utilizado e igual a 28,0 J.K-1.mol-1, é
correto afirmar que a energia necessária para realizar a fusão, a 1 bar e 371k , é
Na figura a seguir, é apresentado o diagrama de equilíbrio de fases sólido-líquido, em função da temperatura, à pressão constante, para o sistema CaCl2 -H2O.
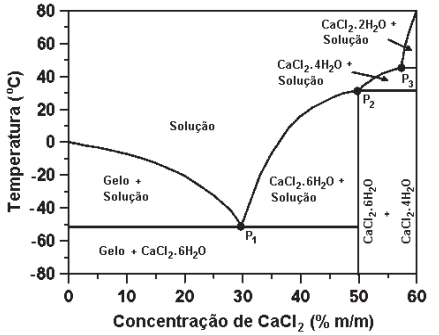
(Disponível em:<https://engineering.purdue.edu/JTRP/Highlights/cacl2-dihydrate-cacl2-2h2o> . Acesso em: 9 fev. 2019. Adaptado.)
Observe o que se afirma a partir desse diagrama.
I. Os pontos P1, P2 e P3 correspondem às diferentes composições eutéticas do sistema.
II. O ponto P1 é o único que corresponde à mistura eutética e há três fases em equilíbrio neste ponto.
III. Independentemente da composição da mistura, à temperatura de 60° C, há somente uma fase presente.
IV. Para qualquer composição da mistura ou condição de temperatura, não é possível obter as fases H2O(s) e CaCl2 .4H2O(s) em equilíbrio.
Uma das ferramentas que pode auxiliar nos estudos de obtenção de tampões ou até mesmo de precipitação, é o digrama de especiação. Nesse diagrama, podem ser observadas as espécies presentes no meio para diferentes valores de pH e suas concentrações (representadas como pC, que é o negativo do logaritmo das concentrações). A seguir, está apresentado o diagrama de especiação do ácido cianídrico, a 25°C para uma concentração total de cianeto igual a 10-3mol/L (pC=3). O ácido cianídrico é altamente tóxico, no entanto é largamente utilizado no tratamento de ouro.
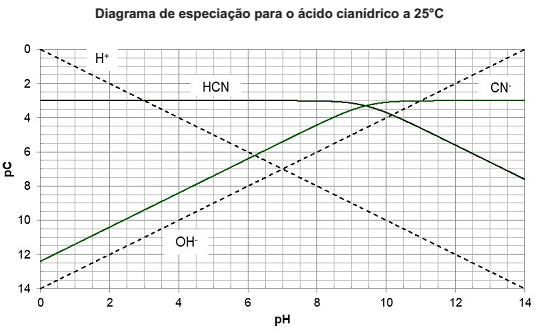
A partir do diagrama, considerando que uma solução com concentração de 10-3mol/L de ácido cianídrico seja
ideal, a 25°C, em um recipiente fechado, o pH da solução será igual a
No estudo da precipitação de íons metálicos, existem vários diagramas que podem ser utilizados, como o de precipitação, o de especiação e o diagrama Eh-pH. Nesse último, para uma faixa de potenciais (Eh) e de pH, podem ser observados todas as espécies presentes, para uma temperatura e concentração do elemento de interesse.
A seguir pode-se observar o diagrama Eh-pH para o cádmio em solução aquosa.
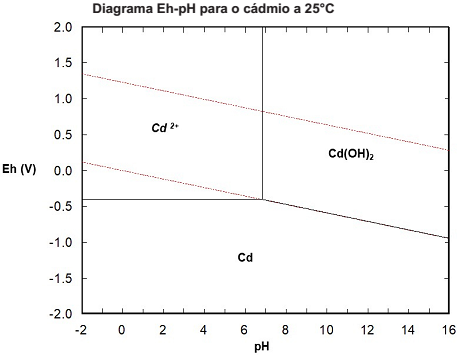
Fonte: Arquivo da Banca Elaboradora.
A partir desse diagrama, é correto afirmar que
Diagramas ternários são diagramas utilizados para sistemas compostos por três substâncias. Os diagramas ternários podem ter o formato de um triângulo equilátero ou um triângulo retângulo. A figura abaixo é um diagrama triângulo retângulo para um sistema composto por ácido acético, água e éter isopropílico, a 20°C.
Nesse diagrama, as linhas sólidas representam a separação entre as regiões em que há somente uma fase ou duas fases em equilíbrio, e as linhas tracejadas representam as linhas de amarração.
Diagrama triângulo retângulo para o sistema ácido acético, água, éter isopropílico a 20°C
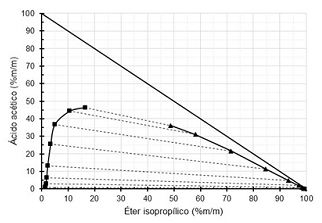
Fonte: Arquivo da Banca Elaboradora.
Um aluno observando esse diagrama fez algumas anotações.
I. Ácido acético é completamente solúvel em água.
II. Ácido acético e éter isopropílico são parcialmente solúveis entre si.
III. Água e éter isopropílico são parcialmente solúveis entre si.
IV. É impossível remover ácido acético de uma solução aquosa utilizando éter isopropílico.
V. Não é possível saber, pelo diagrama, a concentração de água em um determinado ponto.
É correto apenas o que o aluno afirmou em:
Um tubo cilíndrico fechado nas extremidades é dividido em dois compartimentos (A e B) por um pistão móvel. No compartimento A foi adicionado 1g de um gás ideal, que possui massa molar M, a 300K. No compartimento B foi adicionado 1g de um outro gás ideal, que possui massa molar 2M, a 900K.
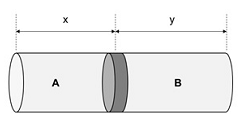
Fonte: Arquivo da Banca Elaboradora.
Quando o sistema entrar em equilíbrio mecânico, a razão entre os comprimentos y e x, será igual a
A seguir são apresentadas as entalpias de formação de alguns compostos. Analise-as
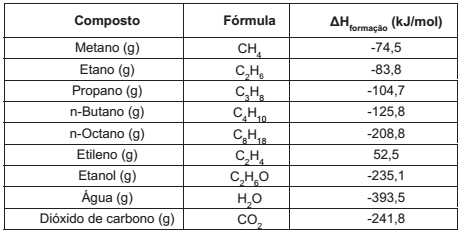
SMITH, J. M.; VAN NESS, H. C.; ABBOTT, M. M. Introdução à termodinâmica da Engenharia Química. 7 ed. Rio de Janeiro: LTC, 2007. p. 514-515.
A partir da análise desses dados, é correto afirmar que
As equações a seguir são as relações termodinâmicas fundamentais para 1 mol de um fluido homogêneo com composição constante.
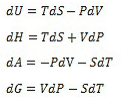
As propriedades termodinâmicas expressas nessas equações são: energia interna (U), entalpia (H), energia de Helmholtz (A), energia de Gibbs (G), temperatura (T), pressão (P), volume (V) e entropia (S).
A partir dessas relações fundamentais, é possível encontrar outras correlações que permitem realizar
experimentos simples para estudos bastante complexos. Por exemplo, caso queira verificar como a energia
de Gibbs varia com a entropia, mantendo-se a temperatura constante, pode-se utilizar os dados de um
experimento em que observa-se a variação da(o)
Um mol de gás, em um vaso fechado, passa por um ciclo termodinâmico de 4 etapas. Na tabela a seguir estão apresentadas as variações da energia interna do gás, o calor adicionado ao sistema e o trabalho realizado pelo sistema em algumas etapas em que foi possível realizar as medições (dados em branco não foram medidos).
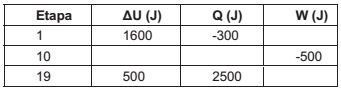
Fonte: Arquivo da Banca Elaboradora.
Na quadragésima etapa, foram adicionados 1300J ao sistema na forma de calor e o trabalho realizado pelo
sistema foi de
Um vaso fechado, a 120°C, contém 0,55mol de fenol e 0,45mol de tolueno. Nessa temperatura, a pressão de vapor do fenol é 13,0kPa e a do metanol é 131,3kPa.
Considerando que o sistema se encontra no ponto de orvalho, que a fase líquida se comporta como uma solução ideal e a fase vapor se comporta como uma mistura de gases ideais, a pressão no interior do vaso é
O saturador adiabático é um equipamento utilizado para umidificar o ar em um processo industrial. Esse equipamento consiste de uma câmara contendo água no estado líquido sobre a qual passa uma corrente de ar. A água evapora adiabaticamente e, assim, o ar que entra seco no equipamento, sai umidificado. Considerando um saturador adiabático que possua uma câmara que comporta 5.000cm3 de água e com uma altura h de 500cm. Ar seco entra no equipamento e, após umidifcado, sai com água a uma concentração igual a 50% da saturação, a uma velocidade constante, sem que haja perturbações na superfície da água. O nível da água é mantida constante devido ao bombeamento de 20cm3 .h-1 de água para dentro da câmara. O sistema opera a 25°C (298K) e 101kPa. O coeficiente de difusão da água no ar é igual a 900cm2 .h-1, a densidade da água líquida é 1,0g.cm-3, a massa molar da água é 18g.mol-1 e a pressão de vapor da água 3,17kPa.
A constante dos gases pode ser admitida como 8314kPa.cm3 .mol-1.K-1.

Fonte: Arquivo da Banca Elaboradora.
O fluxo de água que evapora é igual a
Muitos foram os pesquisadores que contribuíram para as leis conhecidas como Leis dos Gases. Algumas das contribuições mais importantes dos gases ideais estão resumidas nos postulados na lei de Boyle, lei de Charles, lei de Gay-Lussac e lei de Clapeyron. Com relação às leis dos gases, analise as afirmativas a seguir.
I. De acordo com a lei de Boyle, a pressão e o volume de um gás são inversamente proporcionais entre si para um gás ideal.
II. De acordo com a lei de Gay-Lussac, a velocidade de difusão e de efusão de um gás é inversamente proporcional à raiz quadrada de sua densidade.
III. De acordo com a lei de Charles, o volume de um gás é diretamente proporcional à sua temperatura absoluta.
IV. De acordo com a lei de Clapeyron, à volume constante, a pressão de uma certa massa constante de um gás é proporcional à temperatura absoluta a qual está submetida.
Está correto apenas o que se afirma em