Questões Militares de Engenharia Química e Química Industrial - Termodinâmica e Equilíbrio de Fases
Foram encontradas 98 questões
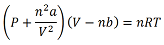
Na equação, as variáveis P, V, n, R, T são usuais, mas os parâmetros (a) e (b) são conhecidos como constantes de Van Der Waals.
Considerar R: 0,0821 atm · L · K−1 · mol−1
Tabela – Constantes de Van Der Waals
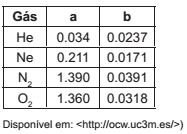
Utilizando a equação de Van Der Waals para gases reais, calcule a pressão real exercida por 16 gramas de gás oxigênio que se encontra em um recipiente de 1L a 27°C.
Para misturas binárias, as condições de equilíbrio para várias composições podem ser facilmente visualizadas em diagramas do tipo Txy e xy, à pressão constante, ou Pxy e xy, à temperatura constante.
Diagrama binário para a mistura Benzeno e Tolueno.
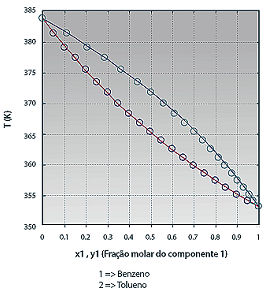
(Disponível em: <http://labvirtual.eq.uc.pt> )
Com base nesse gráfico, é correto afirmar que entre os pontos
Informe se é verdadeiro (V) ou falso (F) o que se afirma abaixo sobre as propriedades termodinâmicas.
( ) Ponto de orvalho é a temperatura na qual se inicia a condensação da mistura.
( ) Ponto de bolha é a temperatura na qual se inicia a ebulição do líquido puro.
( ) Quando a mistura está no ponto de bolha, dizemos que é um líquido insaturado.
( ) Se a mistura estiver aquecida acima do ponto de bolha, dizemos que é vapor superaquecido
A alternativa que apresenta a sequência correta é
Uma amostra de gás ideal sofreu uma transformação termodinâmica à pressão constante igual a 30 N/m2 . O volume e a temperatura absoluta variam como indica o gráfico a seguir.
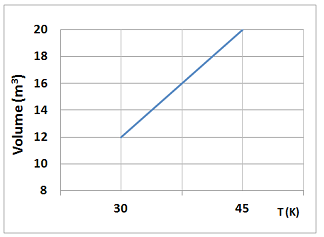
Sabendo-se que, nessa transformação, o gás absorve 400J de calor, pode-se afirmar que a variação de sua
energia interna é de