Questões Militares
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 98 questões
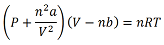
Na equação, as variáveis P, V, n, R, T são usuais, mas os parâmetros (a) e (b) são conhecidos como constantes de Van Der Waals.
Considerar R: 0,0821 atm · L · K−1 · mol−1
Tabela – Constantes de Van Der Waals
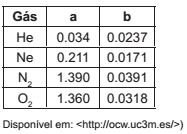
Utilizando a equação de Van Der Waals para gases reais, calcule a pressão real exercida por 16 gramas de gás oxigênio que se encontra em um recipiente de 1L a 27°C.
Para misturas binárias, as condições de equilíbrio para várias composições podem ser facilmente visualizadas em diagramas do tipo Txy e xy, à pressão constante, ou Pxy e xy, à temperatura constante.
Diagrama binário para a mistura Benzeno e Tolueno.
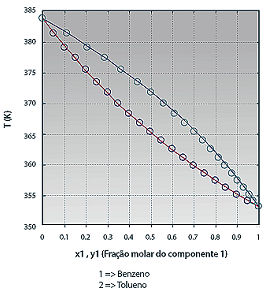
(Disponível em: <http://labvirtual.eq.uc.pt> )
Com base nesse gráfico, é correto afirmar que entre os pontos
Informe se é verdadeiro (V) ou falso (F) o que se afirma abaixo sobre as propriedades termodinâmicas.
( ) Ponto de orvalho é a temperatura na qual se inicia a condensação da mistura.
( ) Ponto de bolha é a temperatura na qual se inicia a ebulição do líquido puro.
( ) Quando a mistura está no ponto de bolha, dizemos que é um líquido insaturado.
( ) Se a mistura estiver aquecida acima do ponto de bolha, dizemos que é vapor superaquecido
A alternativa que apresenta a sequência correta é
Uma amostra de gás ideal sofreu uma transformação termodinâmica à pressão constante igual a 30 N/m2 . O volume e a temperatura absoluta variam como indica o gráfico a seguir.
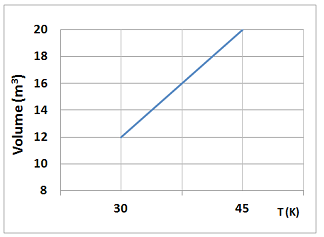
Sabendo-se que, nessa transformação, o gás absorve 400J de calor, pode-se afirmar que a variação de sua
energia interna é de
Analise as Leis da Termodinâmica relacionadas por PW Atkins (2009), em seu livro Físico‐Química.
I. A entropia do universo tende a aumentar.
II. A energia interna de um sistema isolado é constante.
III. A velocidade de variação de momento é igual à força.
IV. As entropias de todas as substâncias perfeitamente cristalinas são as mesmas em T = 0.
É descrita como a Segunda Lei da Termodinâmica apenas a afirmativa
“A termodinâmica química estuda, entre outras coisas, as mudanças de energia que acompanham as reações químicas.”
(Fundamentos de Química Experimental, Maurício Gomes Constantino.)
Em relação à termoquímica, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A máxima quantidade de energia que um sistema químico pode produzir é medida pela variação de energia livre: ΔG.
( ) Na entalpia da transformação, as medidas são geralmente efetuadas não mantendo uma pressão constante e é representada como ΔH.
( ) Uma reação na qual o calor é absorvido (a temperatura da mistura de reação diminui quando reage) é chamada de endotérmica e o ΔH é positivo.
( ) Uma reação na qual o calor é perdido pelos reagentes para o meio ambiente (a temperatura da mistura de reação aumenta quando reage) é dita exotérmica, onde ΔH é negativo.
A sequência está correta em
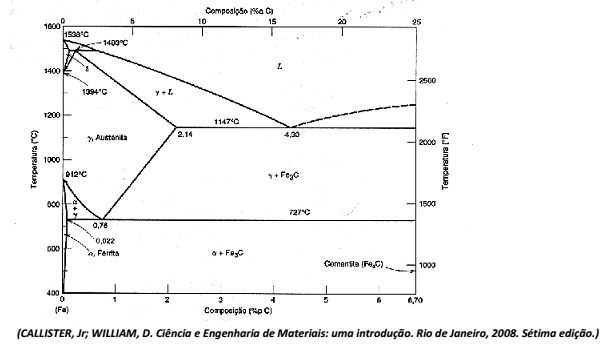
Para um aço contendo 81% de perlita, as porcentagens de ferrita e cementita são, respectivamente:
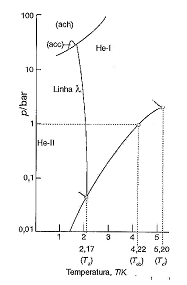
Sobre o diagrama de fases do hélio (4He), analise as afirmativas a seguir.
I. A linha λ assinala as condições para as quais a fase líquida e a fase sólida do hélio estão em equilíbrio. II. O He-II é um superfluido. III. As identificações ach e acc referem-se a fases sólidas distintas com estruturas diferentes do agrupamento dos átomos: uma delas é o agrupamento compacto hexagonal, ach; e a outra, o agrupamento compacto cúbico, acc.
Está(ão) correta(s) apenas a(s) afirmativa(s)
O estado mais simples da matéria é um gás, uma forma da matéria que ocupa qualquer recipiente que a contenha. É conveniente imaginar um gás como um conjunto de moléculas em movimento permanente e aleatório, com velocidades médias que aumentam quando a temperatura se eleva. Um gás difere de um líquido pelo fato de ter suas moléculas muito separadas umas das outras. Sobre os gases, marque V para as afirmativas verdadeiras e F para as falsas.
( ) O tamanho das moléculas é desprezível no sentido de que seus diâmetros são muito menores do que a distância média percorrida entre as colisões.
( ) Um gás real tem o comportamento tanto mais semelhante ao de um gás perfeito quanto mais alta for a pressão.
( ) A velocidade média quadrática das moléculas de um gás é proporcional à raiz quadrada da temperatura e à raiz quadrada da massa molar.
( ) As leis de Boyle e de Charles são exemplos de uma lei limite.
A sequência está correta em
Alguns fatores ocorrem naturalmente, outras não. Um gás, por exemplo, se expande até ocupar todo o volume disponível que lhe é oferecido. Um corpo quente se resfria até atingir a temperatura das suas vizinhanças, e uma reação química avança preferencialmente num sentido e não no sentido inverso. O reconhecimento da existência de duas classes de processos, os espontâneos e os não espontâneos, é resumido pela Segunda Lei da Termodinâmica. Sobre o tema, analise as afirmativas a seguir.
(Considere: ln 2 = 0,69.
ln 2,8 = 1,03.)
I. A variação de entropia de um gás perfeito quando ele se expande isotermicamente do volume Vi até o volume Vf é 8,62 JK–1
II. A variação de entropia do argônio, que está inicialmente a 25°C e 1,00 bar, num recipiente de 0,500 dm3 de volume e que se expande até o volume de 1,000 dm3 , sendo simultaneamente aquecido até 100°C é 0,173 JK–1 .
III. Num ciclo termodinâmico, a variação global de uma função de estado (do estado inicial até o estado final e então de volta para o estado inicial) é igual a zero.
Está(ão) correta(s) apenas a(s) afirmativa(s)
A lei que é usada para identificar o sentido da mudança espontânea, a segunda lei da termodinâmica, também se exprime em termos de uma função de estado, a entropia. A primeira lei usa a energia interna para identificar as mudanças permitidas; a segunda lei usa a entropia para identificar as mudanças espontâneas entre as mudanças permitidas.
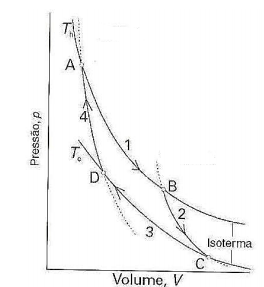
Sobre o ciclo de Carnot, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A variação de entropia é qh/Th, em que qh é a energia na forma de calor fornecida ao sistema pela fonte quente.
( ) Há troca de calor; a variação de entropia é nula.
( ) A variação de entropia do sistema é qc/Tc , qc é positivo.
( ) Não há troca térmica e, portanto, a variação de entropia é nula.
A sequência está correta em
CONSTANTES

DEFINIÇÕES


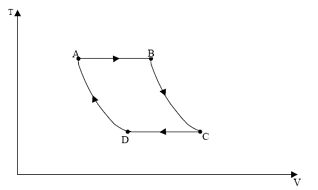
Um motor pulso-jato é uma máquina térmica que pode ser representada por um ciclo termodinâmico ideal de três etapas:
I. Aquecimento isocórico (combustão).
II. Expansão adiabática (liberação de gases).
III. Compressão isobárica (rejeição de calor a pressão atmosférica).
Considerando que essa máquina térmica opere com gases ideais, indique qual dos diagramas pressão versus volume a seguir representa o seu ciclo termodinâmico.
CONSTANTES

DEFINIÇÕES


Analise as afirmativas a seguir e assinale a opção correta, com relação à Primeira Lei da Termodinâmica.
I- A energia interna U de um sistema só pode ser alterada pela transferência de calor entre o sistema e a vizinhança.
II- Quando um sistema recebe calor, sua energia interna aumenta e, quando ele perde calor, sua energia interna diminui.
III- Durante uma expansão adiabática, o gás realiza trabalho sobre as vizinhanças.
IV- Quando trabalho é feito sobre o sistema, sua energia interna diminui e, quando um sistema realiza trabalho, sua energia interna aumenta.
Observe as figuras a seguir.
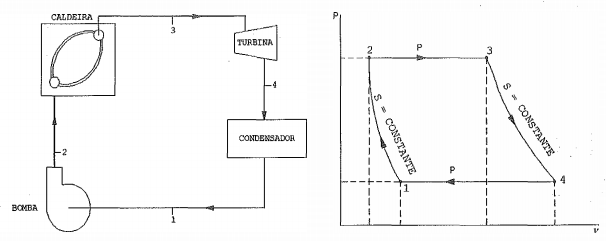
No ciclo ideal Rankine acima representado, o vapor d ’água deixa a caldeira e entra na turbina como vapor superaquecido a 5MPa e 500°C. A pressão no condensador é de 25kPa. Admita que os processos desse ciclo ocorram em regime permanente e com variações desprezíveis de energias cinética e potencial. Nessas condições e utilizando o critério de arredondamento na primeira casa decimal, calcule o rendimento do ciclo e assinale a opção correta.
Dados: