Questões Militares
Sobre termodinâmica e equilíbrio de fases em engenharia química e química industrial
Foram encontradas 98 questões
Considere um equipamento condicionador de ar operando segundo um ciclo de Carnot para manter um ambiente a 27°C„ A carga térmica a ser removida desse ambiente interno é de 6000W„ Sabendo que o ambiente externo está a 37 °C, determine a potência mínima (em W) necessária para acionar esse equipamento, e assinale a opção correta.
Dado :
T(K) = T(°C)+273
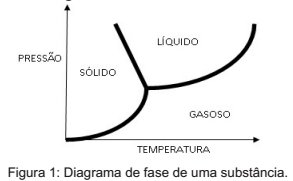
Considere o diagrama de fase de uma substância ilustrado na Figura 1 e assinale a alternativa incorreta.
Ferro e manganês são elementos amplamente utilizados nos processos de fabricação de ligas de aço e, por isso, possuem grande importância industrial e tecnológica. O diagrama mostra as fases em equilíbrio do sistema Fe-Mn para diferentes temperaturas e concentrações.
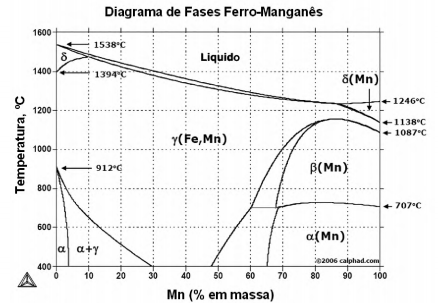
Analise as seguintes afirmações retiradas do diagrama de fases acima.
I. A temperatura liquidus do ferro puro é maior que a do manganês puro.
II. Uma liga com 95% de manganês a 1200°C possui uma fase isenta de ferro.
III. Na temperatura de 912°C ocorre uma transformação eutetoide.
IV. Independentemente do percentual de Mn, a 1000°C o material estará no estado sólido.
Estão corretas apenas as afirmativas
A figura apresentada a seguir representa um diagrama de equilíbrio de fases (hipotético) das ligas A-B.
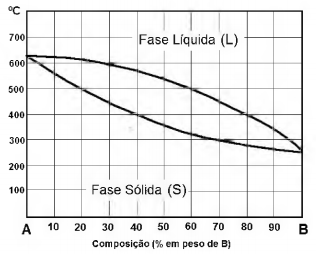
Uma determinada peça composta da liga A-B foi aquecida em condições de equilíbrio até a temperatura de 500°C e
fundiu parcialmente. Sabendo que nesta temperatura a fase sólida possui 80kg do elemento químico B e a fase
líquida possui 40kg do elemento químico A, qual é a percentagem em peso de B da liga que compõe essa peça?
A figura apresentada a seguir representa um diagrama de equilíbrio de fases (hipotético) das ligas A-B. Na temperatura de 250°C a solubilidade de equilíbrio do elemento químico B na fase sólida α é igual a 98% .
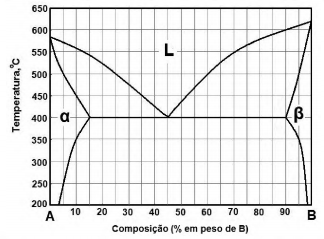
Uma peça de massa 600kg e com 25% em peso de B em sua composição foi resfriada em condições de equilíbrio até a temperatura de 250°C. Calcule a massa, em kg, de faze β precipitada dentro do microconstituinte α primário.
( ) Um sistema aberto troca matéria e energia com sua vizinhança.
( ) Um sistema fechado troca apenas energia com sua vizinhança.
( ) Um sistema isolado não troca material nem energia com sua vizinhança.
( ) 0 trabalho de expansão realizado no vácuo é nulo .
( ) 0 calor pode ser transferido sem que haja uma diferença de temperatura.
I. Quando F=0, o sistema é invariante.
II. Uma solução líquida de álcool em água em equilíbrio com o seu vapor possui um grau de liberdade 3.
III. A adição de um gás inerte a um sistema formado por água em equilíbrio com o seu vapor altera as características do sistema.
Está(ão) correta(s) apenas a(s) afirmativa(s)
A escolha da operação de transferência de massa a ser usada para efetuar-se a separação de uma mistura multicomposta depende da viabilidade operacional, da teoria físico-química e das questões econômicas. O porte necessário para a unidade operacional tem seu custo calculado a partir do conhecimento das limitações do equilíbrio de fase. Sobre equilíbrio de fases, analise as afirmativas.
I. Para o equilíbrio líquido-líquido, na extração em fase líquida, no caso mais simples, o soluto é dividido entre duas fases líquidas insolúveis. Os dados de equilíbrio para este caso podem ser registrados como razões entre a massa de soluto e solvente em cada uma das fases em equilíbrio.
II. A adsorção, que é a forma mais comum do estabelecimento de equilíbrio entre gás e sólido, pode ocorrer mediante mecanismos físicos e químicos. As moléculas do fluido aderem à superfície do adsorvente sólido, e fica estabelecido um equilíbrio entre o fluido adsorvido e a fase fluida restante.
III. Para o equilíbrio sólido-líquido, um estágio de equilíbrio pode ser definido como aquele em que o líquido aderente aos sólidos que saem do estágio não tem a mesma composição que o extrato líquido que sai do mesmo estágio.
Está(ão) correta(s) apenas a(s) afirmativa(s)
( ) Na operação, o fluido de trabalho de uma máquina térmica absorve calor de um reservatório quente, produz uma quantidade líquida de trabalho, descarta calor para um reservatório frio e retorna ao seu estado inicial.
( ) A eficiência térmica da máquina é definida como
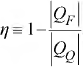
( ) Uma máquina térmica operando de forma irreversível é chamada máquina de Carnot.
( ) Para dois reservatórios de calor dados, nenhuma máquina pode possuir uma eficiência térmica inferior à de uma máquina de Carnot.
O desenvolvimento da termodinâmica é facilitado pela introdução de um tipo especial de processo em sistemas fechados, caracterizado como reversível. Sobre os processos reversíveis analise as afirmativas.
I. Atravessa uma sucessão de estados de equilíbrio.
II. Pode ser revertido em qualquer ponto por uma variação infinitesimal nas condições externas.
III. Tem atrito.
Está(ão) correta(s) apenas a(s) afirmativa(s)
A partir da equação
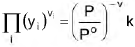 preencha as lacunas abaixo e, em seguida, assinale a alternativa correta.
Um aumento em K, a uma pressão constante, resulta em um (a)_______________ em π
i(yi)Vi isso implica um
deslocamento da reação para direita e um(a) __________ em ξ
e. Um aumento em T causa um(a)
em K e um (a)_______________ em πi(yi)vi,a uma P constante.
preencha as lacunas abaixo e, em seguida, assinale a alternativa correta.
Um aumento em K, a uma pressão constante, resulta em um (a)_______________ em π
i(yi)Vi isso implica um
deslocamento da reação para direita e um(a) __________ em ξ
e. Um aumento em T causa um(a)
em K e um (a)_______________ em πi(yi)vi,a uma P constante.
As características das fases em um sistema imiscível são ilustradas no diagrama temperatura / composição.

A respeito dos diagramas, informe se as afirmativas abaixo são verdadeiras (V) ou falsas (F) e, em seguida, assinale a alternativa que apresenta a seqüência correta.
( ) No ponto de orvalho, o líquido 1 puro começa a se condensar.
( ) No ponto E, o vapor restante se condensa na temperatura T* , produzindo duas fases líquidas, uma da espécie 1 pura e outra da espécie 2 pura.
( ) Um posterior aumento na temperatura na direção de T* causa a condensação continuada do líquido 1 puro.
( ) O líquido 1 puro se condensa primeiro.
A figura a seguir mostra o ciclo de quatro etapas em um diagrama p-v e também em um diagrama T-s; analise-a.
