Questões Militares
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 99 questões
Para avaliar a fertilidade de um solo, podem ser utilizados indicadores de pH, substâncias que mudam de cor em função da acidez ou da alcalinidade do meio em que são empregadas. Considere um agricultor que utilizou um indicador de pH com a seguinte sequência de cores:

Sabe-se que no solo avaliado pelo agricultor, podem ser encontrados os sais Al2 (SO4 ) 3 , Na2 CO3 KNO3 e NaCl e que, o indicador de pH apontou coloração vermelha.
Com base nesse resultado, conclui-se que o solo avaliado apresenta o seguinte sal:
Considere a tabela de constantes de ionização, a 25 ºC.

(Handbook of chemistry and physics, 95th edition, 2014-2015)
A ordem crescente de pH, a 25 ºC, para soluções de mesma concentração dos sais NH4F, NaClO, NaF, NH4CH3COO e NH4ClO4 é:
A preparação de uma solução tampão emprega 100 mL de solução 1 mol/L de ácido etanoico (H3CCOOH, pKa = 4,74) e 100 mL de solução de hidróxido de sódio (NaOH). Para que o pH da solução resultante seja igual ao pKa, a concentração da solução de hidróxido de sódio, em mol.L-1, deve ser igual a
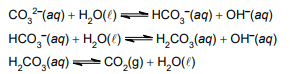
A solução tampão formada nesse sistema envolve o par conjugado ácido-base, nessa ordem:
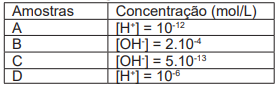
Tabela. Dados de amostras de acordo com suas concentrações hidrogeniônicas e hidroxiliônicas.
Use: log2= 0,3; log5= 0,7 (aproximações)
De acordo com os dados presentes na tabela, assinale a alternativa correta, quanto à acidez, à neutralidade ou à basicidade das amostras A, B, C e D.
Em um experimento laboratorial, misturou-se 25 mL de uma solução aquosa de ácido clorídrico com concentração 0,8 mol L-1 com 25 mL de uma solução aquosa de hidróxido de sódio com concentração 0,6 mol L-1 .
Acerca do experimento, são feitas as seguintes afirmativas:
I – Trata-se de uma reação de neutralização.
II – A substância de caráter alcalino (básico) está em excesso estequiométrico.
III – A solução resultante após a reação possui caráter ácido.
IV – Após a reação, o pH da solução resultante possui valor igual a 2.
Das afirmativas feitas, estão corretas apenas
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio


Sabe-se que a bateria converte Pb e PbO2 em PbSO4 na descarga e que, em condições normais, o pH da solução eletrolítica é menor que 1.
A respeito dessa bateria, foram feitas as seguintes afirmações:
I. Em condições normais, durante a descarga, a semirreação principal que ocorre no ânodo é a i e, no cátodo, é a iv. II. Em condições normais, o potencial da bateria no equilíbrio pode ser representado por E = 1,93 − 0,06pH + 0,06log
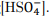 III. Em condições padrão, a eletrólise da água sempre acontece.
IV. Em pH ∼ 2, os potenciais das semirreações secundárias igualam-se aos potenciais das semirreações
principais do ânodo e do cátodo, respectivamente, portanto a eletrólise da água não ocorre
quando o eletrólito tem pH > 2.
III. Em condições padrão, a eletrólise da água sempre acontece.
IV. Em pH ∼ 2, os potenciais das semirreações secundárias igualam-se aos potenciais das semirreações
principais do ânodo e do cátodo, respectivamente, portanto a eletrólise da água não ocorre
quando o eletrólito tem pH > 2. Considerando apenas argumentos baseados no equilíbrio termodinâmico a 25 °C, está(ão) ERRADA(S) apenas a(s) afirmação(ões)
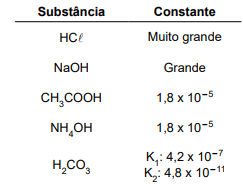
Substância Constante HCl Muito grande NaOH Grande CH3COOH 1,8 x 10–5 NH4OH 1,8 x 10–5 H2CO3 K1 : 4,2 x 10–7 K2 : 4,8 x 10–11

Com base nessas informações, é correto afirmar que:
Considere a tabela dos valores de Kw a diferentes temperaturas.
T (ºC) Kw
10 0,29 × 10–14
15 0,45 × 10–14
20 0,68 × 10–14
25 1,01 × 10–14
30 1,47 × 10–14
50 5,48 × 10–14
Os valores de Kw mostram que, a 50 ºC, o pH da água
pura é
 1, na solução resultante é igual a
1, na solução resultante é igual a Anodo, H2 → 2H+ + 2e- (E° = 0 V) Catodo, Br2 + 2e- → 2Br- (E° = 1,087 V)
A dissociação da água pode ser observada pelo efeito da seguinte semirreação:
O2 + 4e-+ 4H+ → 2H2O E° = 1,229 V
A formação de complexos iônicos de polibrometo ocorre segundo as reações e suas respectivas constantes de equilíbrio:
Br2 + Br- ⇌ Br3- K3 = 16,7 2Br2 + Br- ⇌ Br5- K5 = 37,7
Sejam feitas as seguintes afirmações a respeito dessa bateria:
I. O potencial da célula pode ser aproximado pela equação: Ecatodo - Eanodo = 1,087 + 0,06 pH. II. O solvente (água) é termodinamicamente estável somente a pH < 2,4.
III. Recarregar a bateria com um potencial catódico inferior a 1,229 V garante a estabilidade do solvente. IV. Durante a descarga da bateria, a concentração do HBr aumenta e podem formar complexos ionicos de Br3- e Br5-.
Das afirmações acima, estão CORRETAS
Um experimento usado nas aulas práticas de laboratório da EsPCEx para compreensão da reatividade química é pautado na reação entre magnésio metálico (Mg0) e ácido clorídrico (HCl). Experimentalmente consiste em mergulhar uma fita de magnésio metálico numa solução de concentração 0,1 mol/L de ácido clorídrico. Acerca do processo acima descrito e considerando-se ocorrência de reação, são feitas as seguintes afirmativas:
I – A ocorrência da reação é evidenciada pela formação de bolhas do gás oxigênio.
II – Um dos produtos formados na reação é o óxido de magnésio.
III – O coeficiente estequiométrico do ácido clorídrico, após a escrita da equação da reação corretamente balanceada, é 2.
IV – O agente oxidante dessa reação de oxidorredução é o ácido clorídrico.
V – Considerando a solução inicial do ácido clorídrico de concentração 0,1 mol/L como 100 % ionizado (ácido forte), o pH dessa solução é 2.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima
O indicador vermelho de fenol apresenta cor amarela em
soluções aquosas de pH < 6,4, e, cor vermelha, em soluções
aquosas de pH > 8,2. Na água pura (pH = 7,0), esse indicador
apresenta cor laranja.
A uma amostra de água pura foi acrescentado o indicador vermelho de fenol. Em seguida, foi acrescentado certo óxido que mudou a cor apresentada por esse indicador de laranja para amarela. Esse óxido pode ter sido o