Questões Militares
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 96 questões
(Dados: log 1,49 = 0,17 e log 1,18 = 0,07.)
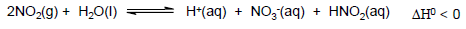
Num ensaio em laboratório, foram acondicionados num sistema fechado N2(g), O2(g), NO2(g) e vapor de água que está em equilíbrio com água líquida. A partir desses dados, considere as seguintes afirmações:
1. O aumento na pressão total do sistema tenderá a diminuir o pH da solução dentro do sistema.
2. Um aquecimento brando tenderá a aumentar o pH da solução dentro do sistema.
3. A adição de excesso de água líquida no sistema tenderá a deslocar o equilíbrio, diminuindo o pH da solução dentro do sistema.
4. A contribuição do ácido nitroso (HNO2) para o pH da solução dentro do sistema é desprezível.
Assinale a alternativa correta
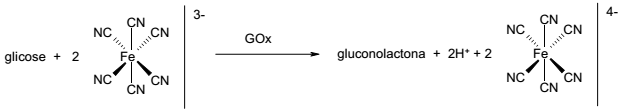
Nesse sistema de medição, faz-se reagir uma amostra contendo glicose com o íon ferricianeto ([Fe(CN)6]3- ) na presença da enzima GOx, obtendo-se como produtos gluconolactona, H+ e ferrocianeto ([Fe(CN)6]4- ). Um eletrodo de platina promove a reação de regeneração do ferricianeto, sendo que a corrente que passa por esse eletrodo é proporcional à concentração de glicose na amostra.
Com base no exposto, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) A enzima GOx catalisa a oxidação da glicose.
( ) No eletrodo de platina ocorre a redução do íon de ferro.
( ) A transformação de glicose em gluconolactona envolve 2 elétrons.
( ) O valor de pH do meio tende a diminuir no processo de detecção de glicose.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Marque a opção correta.
A dissociação do ácido acético em água ocorre de acordo com a seguinte equação:

Ao adicionar acetato de sódio ao sistema representado acima, supõe-se que o(s) efeito(s) observado(s) é(são):
I. pH diminui.
II. pH aumenta.
III. pKa diminui.
IV. pKa aumenta.
São feitas as seguintes comparações de valores de pKa de compostos orgânicos:
I. pKa (CH3COOH) > pKa (CℓCH2COOH)
II. pKa (F3CCOOH) > pKa (Cℓ3CCOOH)
III. pKa (CH3CH2CHCℓCOOH) > pKa (CH3CHCℓCH2COOH)
Das comparações acima, está(ão) CORRETA(S) apenas
A 25 °C, três frascos (I, II e III) contêm, respectivamente, soluções aquosas 0,10 mol L−1 em acetato de sódio, em cloreto de sódio e em nitrito de sódio.
Assinale a opção que apresenta a ordem crescente CORRETA de valores de pHx (x = I,II e III) dessas soluções, sabendo que as constantes de dissociação (K) , a 25 °C, dos ácidos clorídrico (HCl) , nitroso (HNO2) e acético (CH3COOH) , apresentam a seguinte relação:
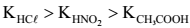
Considere uma amostra aquosa em equilíbrio a 60 °C, com pH de 6,5, a respeito da qual são feitas as seguintes afirmações:
I. A amostra pode ser composta de água pura.
II. A concentração molar de H3O+ é igual à concentração de OH − .
III. O pH da amostra não varia com a temperatura.
IV. A constante de ionização da amostra depende da temperatura.
V. A amostra pode ser uma solução aquosa 0,1mol.L−1em H2 CO3, considerando que a constante de dissociação do H2 CO3 é da ordem de 1 x 10−7 .
Das afirmações acima está(ão) CORRETA(S) apenas
São feitas as seguintes afirmações a respeito dos produtos formados preferencialmente em eletrodos eletroquimicamente inertes durante a eletrólise de sais inorgânicos fundidos ou de soluções aquosas de sais inorgânicos:
I. Em CaCl2 (l) há formação de Ca s) no catodo.
II. Na solução aquosa 1×10-3mol.L −1 −em Na2SO4 há aumento do pH ao redor do anodo.
III. Na solução aquosa 1mol.L−1 em AgNO3 há formação de O2 (g) no anodo.
IV. Em NaBr (l) há formação de Br2 (l) no anodo.
Das afirmações acima, está(ão) ERRADA(S) apenas
A 25 °C, a força eletromotriz da seguinte célula eletroquímica é de 0,45 V: Pt(s)|H2 (g, 1 atm) | H+ ( mol.L-1)|| KCl (0,1 mol.L -1) | Hg2 Cl2 (s) | Hg(l)| Pt (s) Sendo o potencial do eletrodo de calomelano – KCl (0,1 mol.L -1)| Hg2 Cl2 (s)| Hg(l)
– nas condições-padrão
igual a 0,28 V e x o valor numérico da concentração dos íons H+
, assinale a opção com o valor aproximado do
I - O eletrodo de vidro não é um eletrodo de referência, pois é sensível ao pH.
II - O eletrodo indicador do primeiro tipo consiste de um metal em contato com uma solução contendo íons do próprio metal.
III- Um equipamento potenciomêtrico necessita de um eletrodo de referência, um eletrodo indicador e de um dispositivo para leitura de potencial.
Assinale a opção correta.
Considere a adição de 10 mL de ácido bromídrico [1M] a um litro de solução tampão, conforme abaixo:
Solução tampão: ácido acético [0,2M] + acetato de sódio [0,2M]
Sendo o aumento do volume desprezível, qual é o pH da solução tampão e o pH da solução resultante, respectivamente?
Dados: pKa do acido acético = 4,76
pH = pKa + log [sal] / [ácido]
log(0,9) = -0,05

A tabela acima apresenta as cores que os indicadores possuem em diferentes valores de pH . A faixa de viragem indica em quais valores de pH ocorre a transição da cor em meio ácido para a cor em meio básico e vice-versa.
Em relação ao uso de indicadores na titrimetria, é correto afirmar que:
A biodegradação da matéria orgânica produz substâncias húmicas, nas quais os principais componentes são os ácidos húmicos. Estes correspondem a diversas estruturas complexas, que possuem na maioria substituintes fenólicos (pKa = 8) e carboxílicos (pKa = 4). Além de alterar o pH do meio, também são capazes de se ligar a íons metálicos formando coloides. Sobre esse tema, considere as seguintes afirmativas:
1. A presença de substâncias húmicas torna o pH menor que 7. 2. A presença de substâncias húmicas ligadas a íons metálicos é detectada pelo turvamento do meio.
3. O valor medido de pH 6 em uma amostra indica que praticamente todos os substituintes fenólicos estão protonados, enquanto que os substituintes carboxílicos estão desprotonados.
4. O valor medido de pH 4 em uma amostra indica que 50% dos substituintes carboxílicos estão protonados.
Assinale a alternativa correta.