Questões Militares
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 99 questões
Analise a tabela a seguir.
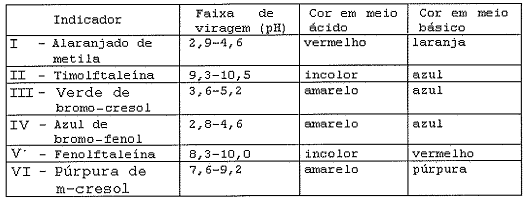
A tabela acima trata de algumas substâncias que podem ser utilizadas como indicadores de neutralização.
Que indicadores dessa tabela poderão ser utilizados para que
seja realizada a titulação de uma solução de amônia com
ácido clorídico?
Um erlenmeyer contém 10,0 mL de uma solução de ácido clorídrico, juntamente com algumas gotas de uma solução de fenolftaleína. De uma bureta, foi-se gotejando uma solução 0,100 M de hidróxido de sódio até o aparecimento de leve coloração rósea. Nesse momento, observou-se um consumo de 20,0 mL da solução alcalina. Pode-se afirmar que a concentração de HCl na solução ácida original era de:
Dados:
Massas atômicas: H = 1,00 u, O = 16,0 u, Na = 23,0 u, Cl = 35,5 u
Uma solução aquosa saturada de gás sulfídrico possui concentração igual a 0,1M e constante de ionização igual a 10-22 Calcule a concentração de sulfeto necessária para precipitação dos cátions do segundo Grupo, sabendo-se que o pH deve ser regulado para se obter uma solução 0,25M em ácido clorídrico, e assinale a opção correta.
Dados: H2S → 2 H+ + S-2
Considere uma amostra aquosa em equilíbrio a 60 °C, com pH de 6,5, a respeito da qual são feitas as seguintes afirmações:
I. A amostra pode ser composta de água pura.
II. A concentração molar de H3O+ é igual à concentração de OH − .
III. O pH da amostra não varia com a temperatura.
IV. A constante de ionização da amostra depende da temperatura.
V. A amostra pode ser uma solução aquosa 0,1mol.L−1em H2 CO3, considerando que a constante de dissociação do H2 CO3 é da ordem de 1 x 10−7 .
Das afirmações acima está(ão) CORRETA(S) apenas
São feitas as seguintes afirmações a respeito dos produtos formados preferencialmente em eletrodos eletroquimicamente inertes durante a eletrólise de sais inorgânicos fundidos ou de soluções aquosas de sais inorgânicos:
I. Em CaCl2 (l) há formação de Ca s) no catodo.
II. Na solução aquosa 1×10-3mol.L −1 −em Na2SO4 há aumento do pH ao redor do anodo.
III. Na solução aquosa 1mol.L−1 em AgNO3 há formação de O2 (g) no anodo.
IV. Em NaBr (l) há formação de Br2 (l) no anodo.
Das afirmações acima, está(ão) ERRADA(S) apenas
A 25 °C, a força eletromotriz da seguinte célula eletroquímica é de 0,45 V: Pt(s)|H2 (g, 1 atm) | H+ ( mol.L-1)|| KCl (0,1 mol.L -1) | Hg2 Cl2 (s) | Hg(l)| Pt (s) Sendo o potencial do eletrodo de calomelano – KCl (0,1 mol.L -1)| Hg2 Cl2 (s)| Hg(l)
– nas condições-padrão
igual a 0,28 V e x o valor numérico da concentração dos íons H+
, assinale a opção com o valor aproximado do
Considerando-se que a primeira ionização do H2SO4 seja praticamente completa e a segunda, parcial, é correto concluir que o pH da água do lago, após a contaminação pelo ácido, atinge valor inferior a 4,0.
Caso o acidente em questão tenha ocorrido em um dia frio, com a temperatura da água a 5 ºC, é correto concluir que, no instante imediatamente anterior ao derramamento, o pH da água do lago era superior a 7,0.
Dados: Kw = 10-14 (mol · L-1)2
Solução do frasco I: ficou rosa em fenolftaleína e amarela no metilorange.
Solução do frasco II: permaneceu incolor em fenolftaleína e vermelha no metilorange.
Solução do frasco III: permaneceu incolor em fenolftaleína e amarela no metilorange.
Sabe-se que a fenolftaleína, em pH acima de 9 apresenta coloração vermelha, enquanto que, em pH abaixo desse valor, é incolor. Sabe-se ainda que o metilorange apresenta coloração vermelha em pH abaixo de 3,5 e amarela em pH acima deste valor.
Sendo assim, os estudantes chegaram à conclusão de que os frascos I, II e III contêm, respectivamente, solução de
A 25 °C, três frascos (I, II e III) contêm, respectivamente, soluções aquosas 0,10 mol L−1 em acetato de sódio, em cloreto de sódio e em nitrito de sódio.
Assinale a opção que apresenta a ordem crescente CORRETA de valores de pHx (x = I,II e III) dessas soluções, sabendo que as constantes de dissociação (K) , a 25 °C, dos ácidos clorídrico (HCl) , nitroso (HNO2) e acético (CH3COOH) , apresentam a seguinte relação:
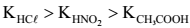
Entretanto, dados experimentais de Ka e Kb não estão de acordo com esta estrutura mas, sim, com *NH3CHRCOO¯. Com relação aos aminoácidos e seus
grupos ácidos e básicos, é correto afirmar que:
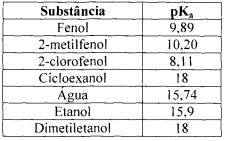
Com base nos valores apresentados no quadro, assinale a alternativa correta.
I. Segundo o princípio de Le Châtelier a adição de H+ ao sistema tampão faz liberar mesma quantidade de OH-.
II. O sistema tampão funciona no sistema digestivo, mas não no sistema sanguíneo.
III. Por adição do sal à solução do ácido para formar o tampão, a percentagem de dissociação do ácido diminui.
IV. A solução tampão sofre pequena variação de pH quando a ela são adicionados íons H+ ou OH-.
Uma barra de ferro e um fio de platina, conectados eletricamente a um voltímetro de alta
impedância, são parcialmente imersos em uma mistura de soluções aquosas de FeSO4 (1,0 mol L–1) e HCl isenta de oxigênio. Um fluxo de gás hidrogênio é mantido constante sobre a parte imersa da superfície da
platina, com pressão nominal (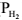 ) de 1,0 atm, e a força eletromotriz medida a 25 °C é igual a 0,292 V.
) de 1,0 atm, e a força eletromotriz medida a 25 °C é igual a 0,292 V.
Considerando-se que ambos os metais são quimicamente puros e que a platina é o polo positivo do elemento galvânico formado, assinale a opção CORRETA que apresenta o valor calculado do pH desse meio aquoso.
Dados: