Questões Militares
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 96 questões
O cianeto de sódio (NaCN) é um sal usado principalmente na indústria de mineração para a recuperação de metais preciosos. É produzido industrialmente pela reação entre ácido cianídrico e hidróxido de sódio, sendo recuperado, após a sua purificação, na forma cristalina ou na forma de soluções contendo entre 27 e 32% m/m.
Sabendo-se que, à temperatura de 25°C, a constante de dissociação do NaCN em água é igual a Ka = 6,2x10-10, é correto afirmar que, para uma concentração igual a 6,25 mol.L-1 (~ 27% m/m), a solução é
As soluções-tampão são muito utilizadas em processos químicos e biológicos para efetuar o controle de pH.
Com relação a essas soluções, avalie as afirmativas a seguir.
I. Um exemplo de solução-tampão é aquela que contém uma base fraca e um sal derivado desta base fraca.
II. A solução-tampão resiste às variações de pH quando se adicionam pequenas quantidades de um ácido ou de uma base.
III. Adicionando-se quantidades equimolares de ácido acético e de hidróxido de sódio à água, obtém-se uma solução-tampão.
É correto apenas o que se afirma em
Qual é o pH de uma solução de NaOH 2,0x10-5 M, considerando que a constante de dissociação da água é de 1,0x10-14 a 25° C?
Dados: log 5 = 0,7 e log 2 = 0,3.
Considerando que: - a solução básica foi parcialmente neutralizada pela solução do ácido; - o ácido clorídrico é um ácido forte (α=100%); - o hidróxido de sódio é uma base forte (α=100%).
O pH da mistura resultante dessa reação de neutralização é
Dado: log 4 = 0,60
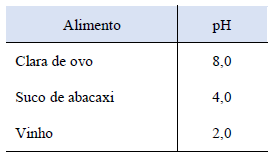
Com base nas informações da tabela abaixo, assinale a alternativa CORRETA.
Considere a seguinte substância:

Com relação à reação abaixo, considerando a tabela acima e o pH da água igual a 7,00, assinale a opção correta.
CH3NH2(aq) + H2O(I) ⇄ CH3NH+3(aq) + OH-(aq)
Quando se dissolvem ácidos fortes em um solvente muito básico, como a água, ocorre a ionização completa desses ácidos e fica impossível comparar a força relativa dos mesmos. Para se evitar esse efeito, chamado de Efeito Nivelador da água, é comum dissolver ácidos fortes em um solvente menos básico, como o ácido acético, sendo possível, assim, comparar a força relativa de ácidos fortes. A esse respeito são dadas, abaixo, as equações de dissociação do HCIO4 e HCI em CH3COOH:
1) HCIO4 + CH3COOH → CH3COOH2- + CIO4- pK1 = 4,88
2) HCI + CH3COOH → CH3COOH2+ + Cl- pK2 =8,55
Com relação á Teoria de ácidos e bases de Bronsted-Lowry
e com base nas equações acima, assinale a opção
INCORRETA.
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Considere dadas as constantes de dissociação ácida (Ka) ou básica (Kb) das seguintes substâncias, a 25°C: fenol (C6H5OH), Ka= 1 x 10-10 e anilina (C6H5NH2), Kb = 7 x 10-10.
Sobre o pH de soluções aquosas dessas substâncias são feitas as seguintes afirmações:
I. A solução aquosa de fenol a 1 x 10-4 mol L-1 tem pH<5.
II. A solução aquosa de anilina a 1 x 10-4 mol L-1 tem pH>9.
III. Ambas as soluções aquosas a 1 x 10-4 mol L-1 têm pH aproximadamente iguais.
Das afirmações acima está(ão) CORRETA(S)
“Solução tampão é uma solução que tem o efeito de manter o pH do meio aproximadamente constante, quando nele são introduzidos íons H+ ou OH– .” Sendo assim, analise as reações a seguir:
I. Solução de HCN + solução de NaCN.
II. Solução de CH3COOH + solução de CH3COONa.
III. Solução de NH4OH + solução NH4Br.
IV. Solução de H2SO4 + solução de CaSO4.
Das reações anteriores, assinale, a seguir, aquela que NÃO é utilizada como solução tampão.
CONSTANTES

DEFINIÇÕES


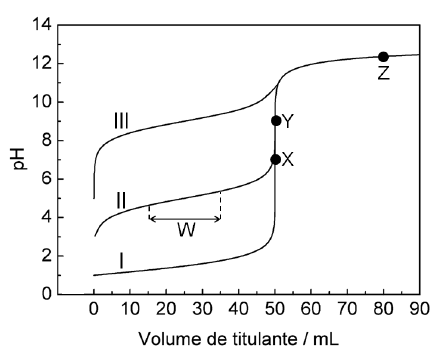
Na figura ao lado são respectivamente apresentadas as curvas de titulação de 50 mL de soluções aquosas 0,1 mol·L-1 dos ácidos I, II e III, tituladas com uma solução aquosa 0,1 mol·L-1 em NaOH. Baseado nas informações contidas na figura, assinale opção ERRADA.
H2S = H+ + HS- HS- = H+ + S-2
K1=1,1.10-⁷
K2=10-14
As reações acima representam a ionização do ácido sulfídrico em água. Numa solução de 0,11 M de H2S, quala [H+]?