Questões Militares
Sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 99 questões
Dados: log (10-1)= -1 log (10-2)= -2 log (10-3 )= -3 log (10-5)= -5 log (10-7)= -7
H2S = H+ + HS- HS- = H+ + S-2
K1=1,1.10-⁷
K2=10-14
As reações acima representam a ionização do ácido sulfídrico em água. Numa solução de 0,11 M de H2S, quala [H+]?
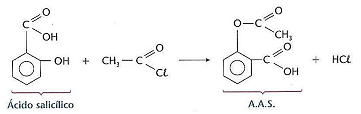
De acordo com o exposto, analise as afirmativas a seguir.
I. Na reação apresentada anteriormente o nome oficial do haleto de acila e do ácido salicílico é cloreto de etanoíla e ácido 2‐hidróxi‐benzóico.
II. Uma solução de 0,015 mol/L de aspirina com pH = 3 possui uma constante de dissociação ácida igual a 1,3 x 10–3.
III.A porcentagem de ácido ionizada na solução de 0,20 mol/L de aspirina com pH = 5 é 1,7%.
Está(ão) correta(s) a(s) afirmativa(s)
(Dados: log 1,49 = 0,17 e log 1,18 = 0,07.)
Dados: Kw = [H30+] [OH- ] = 10-14 Ba(OH)2(s) → Ba+2(aq) + 20H-(aq)
Dados :
log [10-1 ]=-1
log [10-2 ]=-2
log [10-3 ]=-3
log [10-4 ]=-4
log [10-5 ]=-5
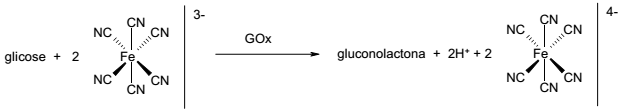
Nesse sistema de medição, faz-se reagir uma amostra contendo glicose com o íon ferricianeto ([Fe(CN)6]3- ) na presença da enzima GOx, obtendo-se como produtos gluconolactona, H+ e ferrocianeto ([Fe(CN)6]4- ). Um eletrodo de platina promove a reação de regeneração do ferricianeto, sendo que a corrente que passa por esse eletrodo é proporcional à concentração de glicose na amostra.
Com base no exposto, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) A enzima GOx catalisa a oxidação da glicose.
( ) No eletrodo de platina ocorre a redução do íon de ferro.
( ) A transformação de glicose em gluconolactona envolve 2 elétrons.
( ) O valor de pH do meio tende a diminuir no processo de detecção de glicose.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.

Com base nestes dados, e sabendo que HA tem constante de ionização igual a 4,0 x 10−10, é coerente afirmar que o indicador HA
(Dado: log 4 = 0,6)
( ) Ao adicionar solução de fenolftaleína em um meio ácido a solução ficará incolor, pois o aumento da concentração de H+ desloca o equilíbrio.
( ) O ácido carbônico é um ácido fraco, extremamente instável, que se forma somente em equilíbrio dinâmico entre a água e o gás carbônico.
( ) Quando reagem com o zinco produzem hidrogênio gasoso.
( ) Reagem com carbonatos e bicarbonatos para produzir monóxido de carbono.
A sequência está correta em
Observe a reação a seguir.
H2C2O4(aq) + 2OH- (aq) → C2O4- (aq) + 2H2O(I)
Suponha que um técnico em química dissolva em água uma
amostra de 1,0g de ácido oxálico impuro e adicione algumas
gotas de indicador ácido-base. Em seguida, ele titula a
solução com NaOH 0,5M. A amostra consome 40mL da solução de
NaOH até atingir o ponto de equivalência. Qual é a massa de
ácido oxálico na amostra inicial?
Assinale a opção que completa corretamente as lacunas da sentença abaixo.
Considere que determinado ácido sofre uma diluição, de modo que sua concentração de íons H+ é alterada de 4x10-7mol/l para 5x10-8 mol/l. Sendo assim, é correto afirmar que o pH da solução original foi alterado de____________ para ___________ .
Dados:
log(2) = 0,301
log(3) = 0,477
log(5) = 0,698
0 hidróxido de sódio (NaOH),também conhecido como soda cáustica, é muito utilizado na indústria como base química na fabricação de papel, tecidos e detergentes. Um técnico em química necessita saber o valor do pH de uma solução aquosa de NaOH, a qual será utilizada na fabricação de um grande lote de detergentes. Para tanto, recebeu uma amostra de 500mL da solução aquosa que contém 0,700g de NaOH. Qual o valor do pH da solução aquosa de NaOH?
Dados:
Constante de ionização da água
(Ka) = [H+ ] [OH-] = 1,0 . 10-14
[H+ ] : concentração do íon H+
[OH- ] : concentração do íon OH-
log (2,9) = 0,46 e log(3,5) = 0,54
Marque a opção correta.
A dissociação do ácido acético em água ocorre de acordo com a seguinte equação:

Ao adicionar acetato de sódio ao sistema representado acima, supõe-se que o(s) efeito(s) observado(s) é(são):
I. pH diminui.
II. pH aumenta.
III. pKa diminui.
IV. pKa aumenta.
A biodegradação da matéria orgânica produz substâncias húmicas, nas quais os principais componentes são os ácidos húmicos. Estes correspondem a diversas estruturas complexas, que possuem na maioria substituintes fenólicos (pKa = 8) e carboxílicos (pKa = 4). Além de alterar o pH do meio, também são capazes de se ligar a íons metálicos formando coloides. Sobre esse tema, considere as seguintes afirmativas:
1. A presença de substâncias húmicas torna o pH menor que 7. 2. A presença de substâncias húmicas ligadas a íons metálicos é detectada pelo turvamento do meio.
3. O valor medido de pH 6 em uma amostra indica que praticamente todos os substituintes fenólicos estão protonados, enquanto que os substituintes carboxílicos estão desprotonados.
4. O valor medido de pH 4 em uma amostra indica que 50% dos substituintes carboxílicos estão protonados.
Assinale a alternativa correta.