Questões Militares
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 102 questões
Analise as afirmativas acerca das equações termoquímicas descritas por Masterton (2010).
I. O valor em módulo ΔH é diretamente proporcional às quantidades dos reagentes ou dos produtos.
II. O valor de ΔH para uma reação é igual ao de seu valor em reação inversa.
III. O valor de ΔH para uma reação é o mesmo independente se ela ocorra em uma ou em uma série de etapas.
Estão corretas as afirmativas
Um depósito contendo cinco tipos de combustíveis pegou fogo. Após o incêndio surgiram discussões à cerca dos que eram guardados pressurizados, por se tratarem de gases na temperatura ambiente e a 1 atm.
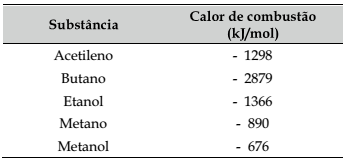
Considere os dados fornecidos nessa tabela, levando em conta apenas o alvo das discussões descritas.
Logo, o combustível que vai liberar maior quantidade
de energia, em kj, por unidade de massa queimada, é o
As variações de entalpia para as seguintes reações podem ser determinadas experimentalmente:
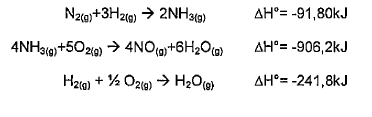
A partir das reações acima apresentadas, pode-se afirmar que a reação a seguir é classificada como:
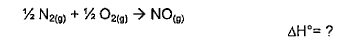
A partir das entalpias padrão de combustão do benzeno(C6H6(l)) e de formação do ciclohexano (C6H12(I) ), assinale aopção que apresenta a quantidade de calor liberada ou recebida para a formação do ciclohexano, em kJ por mol de gás hidrogênio, na reação C6H6(|)+ H2(g) -> C6H12(I).
Dados:
Entalpia padrão de combustão do benzeno: -3.268 kJ.mol-1
Entalpia padrão de formação do ciclohexano: -3.930 kJ.mol-1
H2(g)+ 1/2 02(g) -> H20(l)
ΔH0= -286 kJ.mol-1
Uma das aplicações da trinitroglicerina, cuja fórmula é C3H3N3O9, é a confecção de explosivos. Sua decomposição enérgica gera como produtos os gases nitrogênio, dióxido de carbono e oxigênio, além de água, conforme mostra a equação da reação a seguir:
4 C3H3N3O9 (l) → 6 N2 (g) + 12 CO2 (g) + 1 O2 (g) + 10 H2O (l).
Além de explosivo, a trinitroglicerina também é utilizada como princípio ativo de medicamentos no tratamento de angina, uma doença que acomete o coração. Medicamentos usados no tratamento da angina usam uma dose padrão de 0,6 mg de trinitroglicerina na formulação. Considerando os dados termoquímicos da reação a 25 ºC e 1 atm e supondo que essa massa de trinitroglicerina sofra uma reação de decomposição completa, a energia liberada seria aproximadamente de
Dados: massas atômicas: C = 12 u; H = 1 u; N = 14 u; O = 16 u.
∆Hof (H2O) = - 286 kJ/mol; ∆Hof
(CO2) = - 394 kJ/mol; ∆Hof
(C3H5N3O9) = - 353,6 kJ/mol
O propan-2-ol (álcool isopropílico), cuja fórmula é C3H8O, é vendido comercialmente como álcool de massagem ou de limpeza de telas e de monitores. Considerando uma reação de combustão completa com rendimento de 100% e os dados de entalpias padrão de formação (∆Hof ) das espécies participantes desse processo e da densidade do álcool, a quantidade de energia liberada na combustão completa de 10,0 L desse álcool será de

As equações químicas a seguir representam o processo de síntese dos óxidos de bário e alumínio e suas respectivas entalpias de transformação.
2Ba(s) + O2 (g) → 2 BaO(s) ΔHº = –1.107 kJ
2Al(s) + 3/2O2 (g) → Al2 O3 (s) ΔHº = –1.676 kJ
O metal bário é produzido pela reação do metal alumínio com óxido de bário.
A partir dessas informações, a variação da entalpia para a reação de produção do metal bário é igual a:
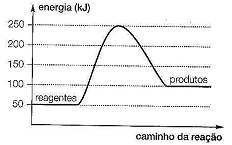
Considerando o gráfico anterior, referente ao diagrama energético de uma reação química, qual o valor da energia de ativação e o ΔH da reação respectivamente?
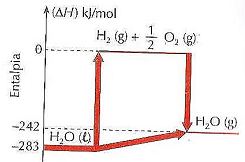
A partir do diagrama de entalpia, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A quantidade de calor envolvido na decomposição de 126 g de H2O(l) → H2(g) + ½ O2(g) é 1.981 kJ/mol.
( ) H2O(l) → H2O(g) ΔH = –41 kJ/mol.
( ) H2(g) + ½ O2(g)→ H2O(g) ΔH = +242 kJ/mol.
A sequência está correta em
Sabendo que a energia de ligação entre dois átomos representa a energia que seria necessária para separá-los a uma distância de separação infinita, observe a tabela a seguir com os valores de energia de ligação para algumas substâncias.
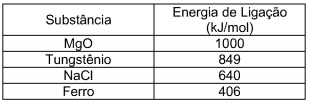
A partir da análise simples dos dados da tabela acima, foram tiradas as seguintes conclusões; analise-as.
I. A temperatura de fusão do tungstênio é maior que a do ferro.
II. A temperatura de fusão do MgO é maior que a do tungstênio.
III. A temperatura de fusão do NaCI é maior que a do ferro.
IV. A temperatura de fusão do MgO é maior que a do NaCI.
As conclusões corretas, que podem ser tiradas a partir da análise simples dos dados dessa tabela, são apenas
Dados: massas atômicas: C = 12 u ; O = 16 u ; H = 1 u
4C(S) + S8(S) → 4 CS2(1) ΔH = + 358,8 kJ
Se o calor absorvido durante a reação foi de 3588 kj, quantos mols de CS2 foram produzidos?
2NO (g) + O2(g),→ 2NO2(g) ΔH = ?
Qual o valor da entalpia padrão da reação acima?
Dados:
N2(g) + O2(g) → 2NO(g) ΔH = +180,5 kJ
N2(g) + 2O2(g) → 2NO2(g) ΔH = + 66,4 kJ
Considere as entalpias padrão de formação dos seguintes compostos:

Sabendo que a capacidade calorífica da água, à pressão constante, vale 75,9 J·mol-1 e que sua entalpia de vaporização é igual a 40,66 kJ·mol−1, assinale a alternativa que melhor corresponda ao número de mols de metano necessários para vaporizar 1 L de água pura, cuja temperatura inicial é 25°C, ao nível do mar.
Considerando as reações a seguir:
 .
.
 ,
,
OΔH da reação a seguir é igual a:
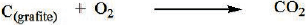 .
.
Observe as reações químicas a seguir.
H2O(I) → H2(g) + 1/2O2(g) Δh = +283 kJ
H2(g) + 1/2O2(g) → H2O(g) Δh = -242 kJ
Qual é o valor do calor de vaporização da água?
I. X(g)+e–→ X (g)+E1 II. X (g)+E2→X(g)+e- III. X(g)+E3→ X+(g)+e- IV. X+ (g)+E4→X2+ (g)+e-
Com base nas equações representadas, pode-se afirmar que:
