Questões Militares
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 102 questões
A análise dos dados termodinâmicos de reações permite a previsão da espontaneidade. Na tabela a seguir estão apresentados os dados termodinâmicos de duas reações químicas.
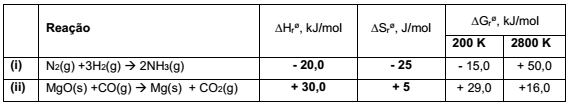
A partir dos dados apresentados, identifique as seguintes afirmativas como verdadeiras (V) ou falsas (F):
( ) A diminuição da temperatura desfavorece a espontaneidade da reação (i).
( ) O aumento da temperatura favorece a espontaneidade da reação (ii).
( ) Na temperatura de 400 K, a reação (i) será espontânea.
( ) Na temperatura de 4000 K, a reação (ii) será espontânea.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
Dados:
Energia de Ligação
C = O 745 kJ/mol
C
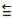 O 1080 kJ/mol
O 1080 kJ/mol C - Cl 328 kJ/mol
Cl - Cl 243 kJ/mol
2 Al (s) + Fe2O3
 (s) 2 Fe (s) + Al2O3
(s) 2 Fe (s) + Al2O3(s) + calor
Reação de Termita
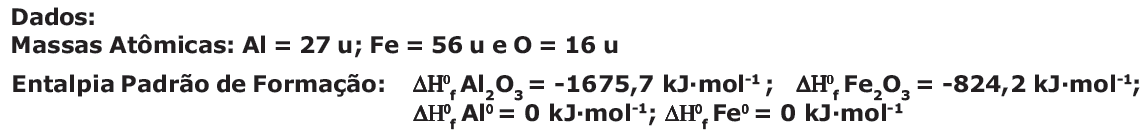


Com base nessas informações e considerando
 a variação de
a variação deentalpia padrão das reações a 25 ºC, julgue os itens a seguir.
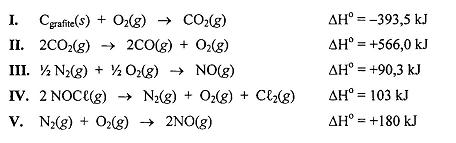
I. Ambas as etapas 1 e 2 ocorrem com absorção de calor.
II. Se a energia da etapa 3 suplantar a soma de 1 e 2, o processo é exotérmico.
III. A etapa 3 pode ser exotérmica ou endotérmica a depender do soluto.
IV. Se a soma de 1 e 2 for maior que o módulo de 3, a dissolução libera calor.
V. Se a energia para separar as partículas do soluto for elevada, não ocorrerá a dissolução.
I. À distância de 0,074 nm a energia cinética é máxima.
II. Quando a distância entre esses dois átomos é 0,074 nm a energia potencial é mínima.
III. A energia necessária para romper um mol de ligações de H2 é 458 kJ.
IV. A distância de 0,074 nm é o comprimento da ligação no H2
(25 °C e 1 atm), expressas em kJ · mol -1.

A alternativa que corresponde ao valor da entalpia da reação abaixo, nas condições-padrão, é:
4 C(grafita)(s) + 5 H2(g) → C4H10(g)
H2O(l) → H2O(v) ΔH= + 44kj/mol
A quantidade de calor necessária para provocar a vaporização de 900 mL de água líquida nesse processo é:
Dados:
Densidade da água = 1,0 g/ml
Massas atômicas: H=1 u; 0 = 16 u
Dos combustíveis citados na tabela, o hidrogênio apresenta o maior poder calorífico por mol de combustível queimado.
Sendo o metilpropano isômero do butano, esses dois hidrocarbonetos, nas mesmas condições experimentais, apresentam o mesmo poder calorífico.
Considerando-se que o rendimento da reação completa de combustão do butano seja de 100%, é correto afirmar que, para a queima completa de 116 g desse hidrocarboneto, seria necessária massa mínima de oxigênio superior a 410 g.
O etanol, a gasolina e o gás natural são combustíveis largamente utilizados no Brasil. Considere para a resolução desta questão que o etanol possui fórmula C2H6O, que a gasolina é constituída apenas por iso-octano (2,2,4-trimetilpentano; C8H18), que o gás natural é constituído apenas por metano (CH4), e os seguintes dados:
Dados: entalpia padrão de formação das espécies
ΔHfº CH4 (g) = - 74,8 kJ mol-1
ΔHfº CO2 (g) = - 393,5 kJ mol-1
ΔHfº H2O (ℓ) = - 285,5 kJ mol-1
ΔHfº C2H6O (ℓ) = - 227,7 kJ mol-1
ΔHfº C8H18 (ℓ) = - 201,5 kJ mol-1
Volume gasoso à 25 ºC e 1 atm = 24,5 L mol-1
Em relação às substâncias e à reação de combustão completa de cada um dos três combustíveis citados, são feitas as seguintes afirmativas:
I – O metano (gás natural) é o combustível que libera a maior quantidade de energia por unidade de massa (grama).
II – 1,15 kg de etanol liberam 39100 kJ.
III – Metano, etanol e iso-octano são hidrocarbonetos.
IV – À 25ºC e 1 atm, metano, etanol e iso-octano são líquidos miscíveis em água em qualquer proporção.
V – O calor de combustão do iso-octano (gasolina) é 5518 kJ mol-1 .
VI – À 25 ºC e 1 atm, o volume de CO2 liberado na combustão de 1,15 kg de etanol é de 2470 L.
Das afirmativas feitas, estão corretas apenas
A partir das equações termodinâmicas a seguir, determine o calor padrão de formação do óxido de cobre sólido e assinale a alternativa que contém seu valor CORRETO.
2 Cu(s) + S(s) ? Cu2S(s) → Hº = - 79,5 kJ
S(s) + O2(g) Δ SO2(g) → Hº = - 297,0 kJ
Cu2S(s) + 2 O2(g) Δ 2 CuO(s) + SO2(g) → Hº = - 527,5 Kj

