Questões Militares
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 102 questões
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
Analise o diagrama.
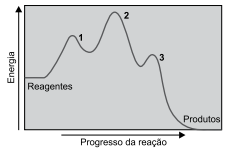
O diagrama representa uma reação _______________ , que ocorre em três etapas, sendo a mais ____________ a etapa 3, porque possui ____________ energia de ativação.
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
I. A parafina da vela é constituída por moléculas de fórmula molecular CxHy, em que x < 8. II. A combustão da parafina na vela tem como principais produtos: negro de fumo, monóxido de carbono, dióxido de carbono e água. III. cor amarela da parte superior da chama indica um processo de combustão que depende da difusão do oxigênio presente no ar. IV. Na região inferior da chama há coloração levemente azulada por conta da maior quantidade de oxigênio difundido pelas zonas de recirculação.
Das afirmações acima, está(ão) CORRETA(S)
C6H12O6(s) + 602(g) → 6CO2(g) + 6 H2O (l) ∆H0 combustão = – 2800 kj/mol
Considere os seguintes dados de massa molar em g/mol:
C=12, H=1, O=16
Com base nas informações do enunciado, assinale a alternativa que apresenta a energia obtida e a quantidade de CO2 liberada na oxidação de 18 g (gramas) de glicose.
Devido ao intenso calor liberado, reações de termita são bastante utilizadas em aplicações militares como granadas incendiárias ou em atividades civis como solda de trilhos de trem. A reação de termita mais comum é a aluminotérmica, que utiliza como reagentes o alumínio metálico e o óxido de ferro III.
A reação de termita aluminotérmica pode ser representada pela equação química não balanceada:
Al (s) + Fe2O3 (s) → Fe (s) + Al2O3 (s) + Calor
Dados: valores arredondados de entalpias padrão de formação das espécies ∆Ho fAl2O3 = - 1676 kJ/ mol; ∆Ho f Fe2O3 = - 826 kJ/mol
Acerca desse processo, são feitas as seguintes afirmativas:
I – Após correto balanceamento, o coeficiente do reagente alumínio na equação química é 2.
II – Essa é uma reação de oxidorredução e o agente oxidante é o óxido de ferro III.
III – Na condição padrão, o ∆H da reação é - 503 kJ para cada mol de óxido de alumínio produzido.
IV – Na condição padrão, para a obtenção de 56 g de ferro metálico, o calor liberado na reação é de 355 kJ.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Observe a tabela abaixo:

O valor da entalpia-padrão de combustão do benzeno liquido a partir das entalpias de formação dos reagentes e produtos da reação, conforme tabela acima, considerando uma combustão completa, é:
Dado: reação de combustão do benzeno:
C6H6 (l) + 15/2 O2(g) → 6CO2(g) + 3H2O(I)
O calorímetro é utilizado no laboratório para inúmeros propósitos, incluindo a determinação da energia produzida na queima de combustíveis e o conteúdo calórico dos alimentos. Numa bomba calorimétrica, assume-se que a quantidade de calor absorvido (ou liberado) pela combinação de água, o interior do calorímetro, a bomba e a mistura reagente seja igual à produzida (ou absorvida) pela reação que ocorre na bomba. Considerando que uma amostra de 0,728 g de etanol (álcool de cereais, C2H5OH) é queimada numa bomba calorimétrica com uma quantidade de gás oxigênio (sob pressão) suficiente para assegurar a combustão completa, qual é o calor molar de combustão do etanol, sabendo que, nesse experimento, a quantidade de água no calorímetro é de 1,20 kg e que a temperatura aumenta de 24,86°C para 29,18°C?
Dados: capacidade calorífica do interior do calorímetro (sem água) é de 1,06 kJ °C-1 e a capacidade calorífica molar da água é 75,3 J °C-1 mol-1.

I – O agente oxidante dessa reação é o O2.
II – O coeficiente estequiométrico da água, após o balanceamento da equação, é 2.
III – Considerando a densidade do etanol 0,8 g/mL (25 ºC; 1 atm), a combustão completa de 1150 mL desse composto libera aproximadamente 27360 kJ.
IV – A quantidade de calor liberada na combustão de 1 mol de etanol é de 278 kJ·mol-1.
Das afirmativas feitas estão corretas apenas
O etanoi é um combustível obtido a partir de fontes renováveis, e cuja equação de combustão a 25°C é a seguinte:
C2H5OH(I) + 3O2(g) → 2CO2(g) + 3H2O(I) ΔH298 =-1368 kJ/mol
Sabendo-se que um volume de 8,05 litros de etanol foi queimado, a quantidade total de calor liberado, em kJ, na combustão acima é:
Dado: densidade do etanoi = 0,8 g/cm3
Considere as seguintes equações termoquímicas:
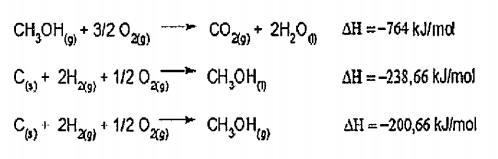
A entalpia de combustão para o metanol líquido, em
kJ/mol, é:
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

O perclorato de amónio (PA) é um dos componentes mais utilizados em propelentes de foguetes. Para aperfeiçoar seu desempenho, hidrogênio pode ser utilizado como aditivo. Considere dadas as entalpias de combustão destas espécies: ΔHC.PA = -189 kJ mol-1; ΔHC.H2 = -286 kJ mol-1.
Com base nessas informações, assinale a opção que apresenta a equação linear da variação da entalpia de combustão da mistura de PA com H2 em função da quantidade de H2.
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Um recipiente de paredes adiabáticas e de volume constante contém duas amostras de água pura separadas por uma parede também adiabática e de volume desprezível. Uma das amostras consiste em 54 g de água a 25 °C e, a outra, em 126 g a 75 °C. Considere que a parede que separa as amostras é retirada e que as amostras de água se misturam até atingir o equilíbrio. Sobre esse processo são feitas as seguintes afirmações:
I. A temperatura da mistura no equilíbrio é de 323 K.
II. A variação de entalpia no processo é nula.
III. A variação de energia interna no processo é nula.
IV. A variação de entropia no processo é nula.
Assinale a opção que apresenta a(s) afirmação(ões) CORRETA(S) sobre a mistura das amostras de água.
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

Considere as seguintes afirmativas:
I - Uma reação química a temperatura e pressão constantes será espontânea se a variação da energia livre de Gibbs (ΔG) for menor que zero.
II - Em um sistema reacional onde a única forma de trabalho observável é o trabalho de expansão, a variação da entalpia (ΔH) é igual à quantidade de calor liberada ou absorvida pela reação, a pressão constante.
III - Para uma substância simples que admite mais de uma forma alotrópica, não há variação de entalpia na conversão de uma forma em outra.
São corretas:
O trioxano, cuja fórmula estrutural plana simplificada encontra-se representada a seguir, é utilizado em alguns países como combustível sólido para o aquecimento de alimentos armazenados em embalagens especiais e que fazem parte das rações operacionais militares.
Considere a reação de combustão completa de um tablete de 90 g do trioxano com a formação de CO2 e H2O. Baseado nas energias de ligação fornecidas na tabela abaixo, o valor da entalpia de combustão estimada para esta reação é
Dados:
Massas Atômicas: O=16 u ; H = 1 u ; C=12 u.

Algumas viaturas militares administrativas possuem motores à combustão que utilizam como combustível a gasolina. A queima (combustão) de combustíveis como a gasolina, nos motores à combustão, fornece a energia essencial para o funcionamento dessas viaturas militares. Considerando uma gasolina na condição padrão (25 °C e 1 atm), composta apenas por n-octano (C8H18) e que a sua combustão seja completa (formação exclusiva de CO2 e H2O gasosos como produtos), são feitas as seguintes afirmativas:
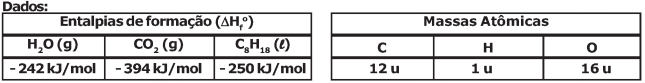
I - a combustão da gasolina (C8H18) é uma reação exotérmica;
II - na combustão completa de 1 mol de gasolina, são liberados 16 mols de gás carbônico (CO2);
III - a entalpia de combustão (calor de combustão) dessa gasolina é - 5080 kJ/mol (ΔHc=-5080 kJ/mol);
IV - o calor liberado na combustão de 57 g de gasolina é de 1270 kJ.
Das afirmativas apresentadas estão corretas apenas a