Questões Militares
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 101 questões
A análise dos dados termodinâmicos de reações permite a previsão da espontaneidade. Na tabela a seguir estão apresentados os dados termodinâmicos de duas reações químicas.
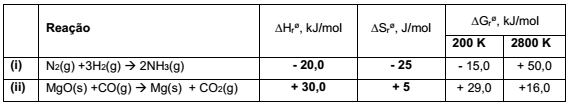
A partir dos dados apresentados, identifique as seguintes afirmativas como verdadeiras (V) ou falsas (F):
( ) A diminuição da temperatura desfavorece a espontaneidade da reação (i).
( ) O aumento da temperatura favorece a espontaneidade da reação (ii).
( ) Na temperatura de 400 K, a reação (i) será espontânea.
( ) Na temperatura de 4000 K, a reação (ii) será espontânea.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
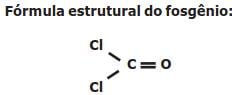
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
Dados:
Energia de Ligação
C = O 745 kJ/mol
C
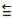 O 1080 kJ/mol
O 1080 kJ/mol C - Cl 328 kJ/mol
Cl - Cl 243 kJ/mol
Sobre o incidente do meteoro russo, assinale a alternativa correta:
Sobre a fumaça que anuncia a escolha do papa, assinale a alternativa correta:
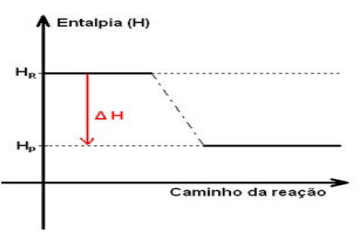
De acordo com o gráfico acima pode concluir se que trata se de uma reação Hp = 250, Hr = 480: I - Espontânea. II - Exotérmica, pois ocorreu um ganho de energia. III - Necessita apenas de um estímulo para que ocorra. IV - Sendo o Hp = 250 kj e Hr = 480kj o delta será de +130 kj. V - Endotérmica, pois ocorreu uma perda de energia. VI - Sendo o Hp = 250 e Hr = 480 delta H será de -130kj. Estão incorretas:
São feitas as seguintes afirmações sobre o que Joule demonstrou em seus experimentos do século XIX:
I. A relação entre calor e trabalho é fixa.
II. Existe um equivalente mecânico do calor.
III. O calor pode ser medido.
Das afirmações acima, está(ão) CORRETA(S) apenas
Substância Massa específica (g ∙ cm−3) Calor específico (J ∙ g−1 ∙ K−1)
H2O 1,00 4,18
Ti 4,54 0,52
Cr 7,18 0,45
Ni 8,90 0,44
2 Al (s) + Fe2O3
 (s) 2 Fe (s) + Al2O3
(s) 2 Fe (s) + Al2O3(s) + calor
Reação de Termita
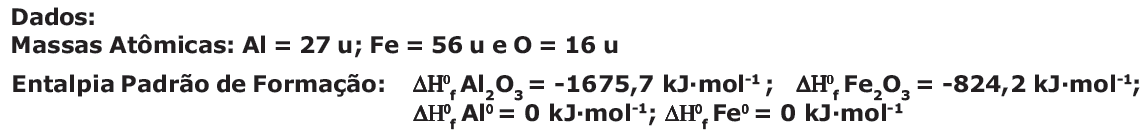
O etanol, utilizado como combustível em carros flex, é produzido pelo processo de fermentação, do caldo de cana, “garapa”, onde leveduras transformam a sacarose em álcool, segundo a reação simplificada:
C12H22O11 + H2O → 2C6 H12O6
C6H12O6 → CH3CH2OH + 2CO2
∆H = -23,5kcal
A fermentação da sacarose trata-se de um
processo:
O perclorato de potássio (KClO4) é usado como oxidante em propelentes e pirotécnicos. Calcule o calor necessário para aumentar a temperatura de 5,0 g de KClO4, de 25°C até 90° C, e assinale a opção correta.
Dado: Capacidade calorífica específica do KClO4 = 0,8111 J.K-1 . g-1
Observe o ciclo de Born-haber apresentado abaixo.
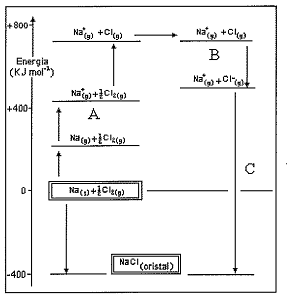
No ciclo de Born-haber apresentado acima quais os nomes das
energias representadas pelas letras A, B e C, respectivamente?
Um sistema com volume de 25 litros absorve 1 KJ de calor. Qual a variação de energia quando o sistema se expande para um volume de 29 litros, contra uma pressão constante externa de 1 atm?
Considere:
calor absorvido pelo sistema (+ ) ;
Calor perdido pelo sistema (-) ;
Trabalho realizado pelo sistema (-) ;
Trabalho realizado sobre o sistema (+ ) ; e
1 l.atm = 100 J
Calcule a entalpia padrão de combustão de glicose, e assinale a opção correta.
Dados:
C6H12O6 (s) ΔH formação = -1268 KJ/mol
CO2 (g) ΔH formação = -393 KJ/mol
H2O (1) ΔH formação = -286 KJ/mol
Analise a reação a seguir.
3 C + 4 H2(g) → C3H8(g)
Calcule o ΔH da reação acima, e assinale a opção correta.
Dados:
C3H8(g)+5 O2(g) → 3 CO2(g) + 4 H2O(l) ΔH = -2220 KJ
C + O2(g) → CO2(g) ΔH = -394 KJ
H2 (g) + 1/2 O2(g) + H2O(l) ΔH = -286 KJ
A reação de sulfonação do naftaleno ocorre por substituição eletrofílica nas posições α e β do composto orgânico, de acordo com o diagrama de coordenada de reação a 50 °C.
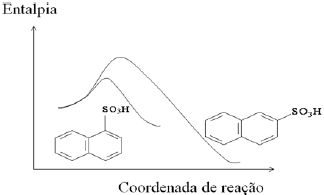
Com base neste diagrama, são feitas as seguintes afirmações:
I. A reação de sulfonação do naftaleno é endotérmica.
II. A posição α do naftaleno é mais reativa do que a de β.
III. O isômero β é mais estável que o isômero α.
Das afirmações acima, está(ão) CORRETA(S) apenas