Questões Militares de Química - Transformações Químicas e Energia
Foram encontradas 371 questões
Considerando a classificação das formas de corrosão segundo a sua morfologia, correlacione os termos técnicos a suas definições e assinale a opção que apresenta a sequência correta.
TERMOS TÉCNICOS
I- Intergranular
II- Dezincificação
III- Empolamento pelo hidrogênio
IV- Transgranular
V- Filiforme
DEFINIÇÕES
( ) A corrosão se processa nos grãos da rede cristalina do material metálico, o qual, perdendo suas propriedades mecânicas, poderá fraturar à menor solicitação mecânica.
( ) É a corrosão que ocorre em ligas de latão, em que se observa o aparecimento de regiões de coloração avermelhada, contrastando com a característica coloração amarela dos latões.
( ) A corrosão se processa entre os grãos da rede
cristalina do material metálico, o qual perde suas
propriedades mecânicas e pode fraturar quando
solicitado por esforços mecânicos.
( ) A corrosão se processa sob a forma de finos filamentos, mas não profundos, que se propagam em diferentes direções e que não se ultrapassam, pois admite-se que o produto de corrosão, em estado coloidal, apresente carga positiva, daí a repulsão.
( ) Corrosão que ocorre quando o hidrogênio atômico penetra no metal e difunde-se rapidamente para regiões com descontinuidades, onde se transforma em hidrogênio molecular, exercendo pressão e originando a formação de bolhas.
O urânio-235 (235U) é utilizado como combustível em diversos tipos de reatores nucleares de fissão para a produção de energia elétrica, sendo esses reatores projetados para induzir e sustentar uma reação nuclear em cadeia lenta e controlada. A equação 1 ilustra uma das possíveis reações nucleares de fissão induzida que ocorrem com o 235U, enquanto que a equação 2 ilustra a reação de decaimento nuclear do antimônio-131 (131Sb), um dos diversos produtos gerados pela fissão do 235U, até a formação de um núcleo estável de xenônio-131 (131Xe).
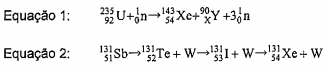
Nas equações acima, X, Y, W e o tipo de decaimento
nuclear ilustrado na equação 2 são, respectivamente:
O calorímetro é utilizado no laboratório para inúmeros propósitos, incluindo a determinação da energia produzida na queima de combustíveis e o conteúdo calórico dos alimentos. Numa bomba calorimétrica, assume-se que a quantidade de calor absorvido (ou liberado) pela combinação de água, o interior do calorímetro, a bomba e a mistura reagente seja igual à produzida (ou absorvida) pela reação que ocorre na bomba. Considerando que uma amostra de 0,728 g de etanol (álcool de cereais, C2H5OH) é queimada numa bomba calorimétrica com uma quantidade de gás oxigênio (sob pressão) suficiente para assegurar a combustão completa, qual é o calor molar de combustão do etanol, sabendo que, nesse experimento, a quantidade de água no calorímetro é de 1,20 kg e que a temperatura aumenta de 24,86°C para 29,18°C?
Dados: capacidade calorífica do interior do calorímetro (sem água) é de 1,06 kJ °C-1 e a capacidade calorífica molar da água é 75,3 J °C-1 mol-1.
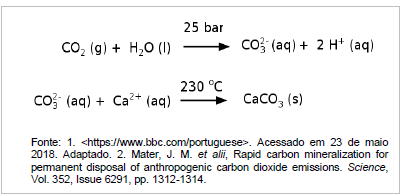
A remoção desse gás da atmosfera ocorre por:

I – O agente oxidante dessa reação é o O2.
II – O coeficiente estequiométrico da água, após o balanceamento da equação, é 2.
III – Considerando a densidade do etanol 0,8 g/mL (25 ºC; 1 atm), a combustão completa de 1150 mL desse composto libera aproximadamente 27360 kJ.
IV – A quantidade de calor liberada na combustão de 1 mol de etanol é de 278 kJ·mol-1.
Das afirmativas feitas estão corretas apenas