Questões Militares
Sobre transformações químicas e energia em química
Foram encontradas 365 questões
Pela eletrólise da bauxita se obtém o alumínio. Nessa eletrólise, ocorre a formação de oxigênio que reage com um dos eletrodos de carbono utilizados no processo. A equação não balanceada que representa o processo global é: Al2(líquido) + C(sólido) => CO2(gasoso) + Al(sólido) . Para dois mols de Al2O3, quantos mols de Al e CO2 são produzidos nesse processo?
Em um experimento de laboratório, cloreto de alumínio, cloreto de zinco e carbonato de sódio são dissolvidos, individualmente, em três recipientes separados contendo água neutra aerada com pH = 7. Uma placa de ferro metálico é imersa em cada um dos recipientes, que são mantidos à temperatura de 25 °C.
Admitindo-se as condições experimentais apresentadas acima, são feitas as seguintes afirmações em relação à influência da hidrólise dos sais na velocidade de corrosão das placas metálicas:
I. O cátion alumínio hidratado forma soluções aquosas que aceleram a corrosão do ferro.
II. As soluções aquosas produzidas pela hidrólise do ânion carbonato inibem a corrosão do ferro.
III. A corrosão do ferro é inibida pela solução aquosa formada no processo de hidrólise do cátion zinco hidratado.
Das afirmações acima, está(ão) CORRETA(S) apenas
Assinale a opção CORRETA que apresenta o potencial de equilíbrio do eletrodo A l3+ /A l ,em volt, na escala do eletrodo de referência de cobre-sulfato de cobre, à temperatura de 25 °C, calculado para uma concentração do íon alumínio de 10-3 mol-1 .
Dados: Potenciais de eletrodo padrão do cobre-sulfato de cobre
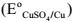 e do alumínio
e do alumínio 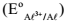 , na escala do
eletrodo de hidrogênio, nas condições-padrão:
, na escala do
eletrodo de hidrogênio, nas condições-padrão: 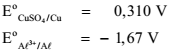
Em um experimento eletrolítico, uma corrente elétrica circula através de duas células durante 5 horas. Cada célula contém condutores eletrônicos de platina. A primeira célula contém solução aquosa de íons Au3+ enquanto que, na segunda célula, está presente uma solução aquosa de íons Cu2+ .
Sabendo que 9,85 g de ouro puro foram depositados na primeira célula, assinale a opção que corresponde à massa de cobre, em gramas, depositada na segunda célula eletrolítica.
Considere a energia liberada em
I. combustão completa (estequiométrica) do octano e em
II. célula de combustível de hidrogênio e oxigênio.
Assinale a opção que apresenta a razão CORRETA entre a quantidade de energia liberada por átomo de hidrogênio na combustão do octano e na célula de combustível.
Dados: Energias de ligação, em KJ mol-1:
C – C 347 H – H 436
C – H 413 H – O 464
C = O 803 O = O 498
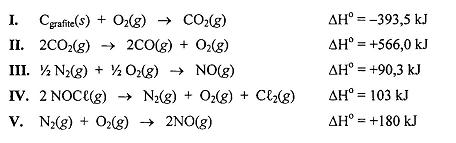
Considere as informações abaixo para responder a questão.
A seguir são apresentados os potências padrão de redução para algumas semirreações:

Considere as informações abaixo para responder a questão.
A seguir são apresentados os potências padrão de redução para algumas semirreações:

I. Ferro sólido colocado em solução de Sn 2+ (aq) não reagirá.
II. Solução de cobre(II) pode ser conservada em tonéis de estanho.
III. No eletrodo padrão de hidrogênio o pH é igual a zero.
IV. Uma pilha com eletrodo de cobre em solução de Cu 2+ (aq) 0,5 mol/l e estanho em solução de Sn 2+ (aq) 0,5 mol/l, apresenta 0,48 V de f.e.m.
Considere a equação abaixo para responder a questão.

I. Ambas as etapas 1 e 2 ocorrem com absorção de calor.
II. Se a energia da etapa 3 suplantar a soma de 1 e 2, o processo é exotérmico.
III. A etapa 3 pode ser exotérmica ou endotérmica a depender do soluto.
IV. Se a soma de 1 e 2 for maior que o módulo de 3, a dissolução libera calor.
V. Se a energia para separar as partículas do soluto for elevada, não ocorrerá a dissolução.
I. A fusão do enxofre elementar,S8(s) produz moléculas S8
II. Sílica, (SiO2)n é um exemplo de sólido molecular.
III. A fusão da sílica, (SiO2)n, ocorre com quebra das ligações Si-O.
IV. Sólidos iônicos são bons condutores de eletricidade.
V. As partículas formadoras dos sólidos metálicos são átomos.
I. À distância de 0,074 nm a energia cinética é máxima.
II. Quando a distância entre esses dois átomos é 0,074 nm a energia potencial é mínima.
III. A energia necessária para romper um mol de ligações de H2 é 458 kJ.
IV. A distância de 0,074 nm é o comprimento da ligação no H2
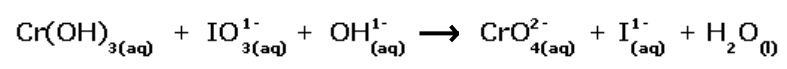
Considerando o método de balanceamento de equações químicas por oxi-redução, a soma total dos coeficientes mínimos e inteiros das espécies envolvidas, após o balanceamento da equação iônica, e o agente oxidante são, respectivamente,
Considere duas reações químicas, mantidas à temperatura e pressão ambientes, descritas pelas equações abaixo:
I. H2(g) + 1/2 O2(g) → H2O(g)
ΙΙ. H2(g) + 1/2O2(g) → H2O(l )
Assinale a opção que apresenta a afirmação ERRADA sobre estas reações.
Em um processo de eletrodeposição de níquel, empregou-se um eletrodo ativo de níquel e um eletrodo de cobre, ambos parcialmente imersos em uma solução aquosa contendo sais de níquel (cloreto e sulfato) dissolvidos, sendo este eletrólito tamponado com ácido bórico. No decorrer do processo, conduzido à temperatura de 55 °C e pressão de 1 atm, níquel metálico depositou-se sobre a superfície do eletrodo de cobre. Considere que as seguintes afirmações sejam feitas:
I. Ocorre formação de gás cloro no eletrodo de cobre.
II. A concentração de íons cobre aumenta na solução eletrolítica.
III. Ocorre formação de hidrogênio gasoso no eletrodo de níquel.
IV. O ácido bórico promove a precipitação de níquel na forma de produto insolúvel no meio aquoso.
Com relação ao processo de eletrodeposição acima descrito, assinale a opção CORRETA.
Sabe-se que a 25 °C as entalpias de combustão (em kJ mol−1) de grafita, gás hidrogênio e gás metano são, respectivamente: –393,5; –285,9 e –890,5. Assinale a alternativa que apresenta o valor CORRETO da entalpia da seguinte reação:
C(grafita) + 2H2 (g) → CH4(g)
Uma barra de ferro e um fio de platina, conectados eletricamente a um voltímetro de alta
impedância, são parcialmente imersos em uma mistura de soluções aquosas de FeSO4 (1,0 mol L–1) e HCl isenta de oxigênio. Um fluxo de gás hidrogênio é mantido constante sobre a parte imersa da superfície da
platina, com pressão nominal (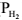 ) de 1,0 atm, e a força eletromotriz medida a 25 °C é igual a 0,292 V.
) de 1,0 atm, e a força eletromotriz medida a 25 °C é igual a 0,292 V.
Considerando-se que ambos os metais são quimicamente puros e que a platina é o polo positivo do elemento galvânico formado, assinale a opção CORRETA que apresenta o valor calculado do pH desse meio aquoso.
Dados: 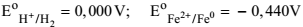
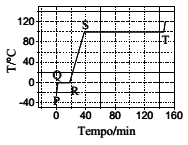
A figura ao lado apresenta a curva de aquecimento de 100 g de uma substância pura genérica no estado sólido. Sabe-se que calor é fornecido a uma velocidade constante de 500 cal min–1. Admite-se que não há perda de calor para o meio ambiente, que a pressão é de 1 atm durante toda a transformação e que a substância sólida apresenta apenas uma fase cristalina. Considere que sejam feitas as seguintes afirmações em relação aos estágios de aquecimento descritos na figura:
I. No segmento PQ ocorre aumento da energia cinética das moléculas.
II. No segmento QR ocorre aumento da energia potencial.
III. O segmento QR é menor que o segmento ST porque o calor de fusão da substância é menor que o seu calor de vaporização.
IV. O segmento RS tem inclinação menor que o segmento PQ porque o calor específico do sólido é maior que o calor específico do líquido.
Das afirmações acima, está(ão) ERRADA(S):
Na equação da reação de óxido-redução, representada no quadro abaixo, a soma dos menores coeficientes estequiométricos inteiros, necessários para balanceá-la, e o agente redutor são, respectivamente,

