Questões Militares
Sobre transformações químicas e energia em química
Foram encontradas 365 questões
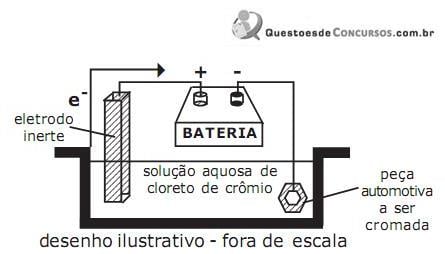
nessa peça foi de
Dados:
massas atômicas Cr = 52 u e Cl = 35,5 u.
1 Faraday = 96500 C/mol de e-
Os Curie continuaram a analisar os resíduos de uranimite e, em julho de 1898, obtiveram um extrato de bismuto quatrocentas vezes mais radioativo que o próprio urânio”. (Tio Tungstênio – memórias de uma infância química – Oliver Sacks – pag 257).
Considerando a meia vida do bismuto (214Bi), que é de 20 minutos, e uma amostra inicial de 100,0 g de 214Bi, a quantidade restante de 214Bi dessa amostra, que o casal Curie observaria, passada uma hora, seria de
O etanol, utilizado como combustível em carros flex, é produzido pelo processo de fermentação, do caldo de cana, “garapa”, onde leveduras transformam a sacarose em álcool, segundo a reação simplificada:
C12H22O11 + H2O → 2C6 H12O6
C6H12O6 → CH3CH2OH + 2CO2
∆H = -23,5kcal
A fermentação da sacarose trata-se de um
processo:
Os processos de corrosão são considerados reações químicas heterogêneas ou reações eletroquímicas que se passam geralmente na superfície de separação entre o metal e o meio corrosivo. A caracterização da forma de corrosão auxilia bastante no esclarecimento do mecanismo e na aplicação de medidas adequadas de proteção. Relacione as formas de corrosão às suas respectivas características fundamentais e, em seguida, assinale a alternativa que apresenta a sequência correta.
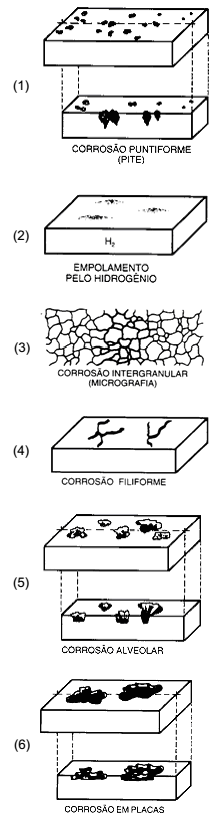
(Gentil, Vicente, 2007)
( ) a corrosão se processa entre os órgãos da rede cristalina do
material metálico.
( ) a corrosão se processa sob forma de finos filamentos, mas não profundos.
( ) o hidrogênio atômico penetra no material metálico, se transforma em hidrogênio molecular, exercendo pressão e originando a formação de bolhas.
( ) a corrosão se processa na superfície metálica produzindo sulcos ou escavações que apresentam fundo arredondado e profundidade geralmente menor que o seu diâmetro.
( ) a corrosão se processa em pontos ou pequenas áreas localizadas na superfície metálica produzindo cavidades que apresentam o fundo de forma angulosa e profundidade geralmente maior do que seu diâmetro.
( ) a corrosão se localiza em regiões da superfície metálica e não em toda sua extensão, formando placas com escavações.
“Corrosão é a deteriorização de um material, geralmente metálico, por ação química ou eletroquímica do meio ambiente aliada ou não a esforços mecânicos.” (Gentil, 1994)
Com base na afirmação, analise as figuras abaixo e, em seguida, assinale a alternativa que representa uma reação de oxi-redução eletroquímica.
O perclorato de potássio (KClO4) é usado como oxidante em propelentes e pirotécnicos. Calcule o calor necessário para aumentar a temperatura de 5,0 g de KClO4, de 25°C até 90° C, e assinale a opção correta.
Dado: Capacidade calorífica específica do KClO4 = 0,8111 J.K-1 . g-1
Observe o ciclo de Born-haber apresentado abaixo.
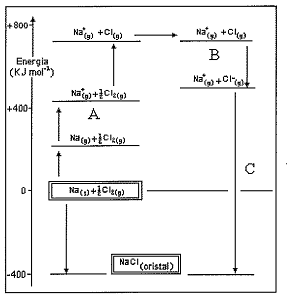
No ciclo de Born-haber apresentado acima quais os nomes das
energias representadas pelas letras A, B e C, respectivamente?