Questões Militares
Sobre transformações químicas e energia em química
Foram encontradas 365 questões
Observe a reação de oxirredução não balanceada a seguir.
Cu(s) + Ag+(aq) → Ag(s) + Cu2+(aq)
A soma de todos os coeficientes estequiométricos da reação
balanceada é :
O esquema abaixo, ilustra uma pilha eletroquímica conhecida como Pilha da Daniell.
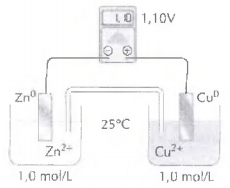
Assinale a opção correta com relação ao processo eletroquímico que ocorre na pilha de Daniell.
Observe a tabela a seguir.
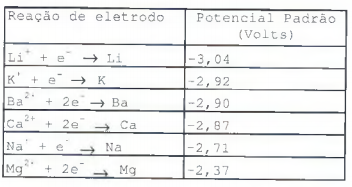
O potencial padrão de eletrodo é uma expressão quantitativa
da facilidade com que um elemento perde elétrons. A tabela
acima exibe valor do potencial padrão de eletrodos de metal.
Sendo assim, é correto afirmar que o agente redutor mais
forte do Cálcio é o:
Observe a figura a seguir.
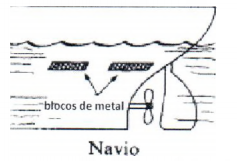
Para proteger da corrosão os cascos de navios, que são constituídos basicamente de ferro, é comum utilizarem-se blocos de um metal acoplados ao casco, conhecidos como metais de sacrifício, conforme representado na figura acima.
Dados:
Potenciais Padrão de Redução:
Fe2+ + 2e ↔ Fe E° = -0,44V
Cu2+ + 2e ↔ Cu E° = +0,34V
Zn2- + 2e ↔ Zn E° = -0,76V
Ni2+ + 2e ↔ Ni E° = -0,25V
Ag+ + e ↔ Ag E° = +0,79V
Pb2+ + 2e ↔ Pb E° = -0,13V
Utilizando os valores de potenciais acima relacionados, qual
é o metal de sacrifício que oferecerá melhor proteção ao
casco do os valores do navio?
Sabendo-se que
( 1 ) Mg → Mg2+ + 2e- com E10 = 2,37 V, e
( 2 ) Sn2+ + 2e- → Sn com E20 = -0,14 V,
Em que E10 e E20 são as tensões elétricas decorrentes dessas reações, respectivamente, calcule a tensão obtida na reação abaixo.
Mg(s) + Sn2+ → Mg2+ + Sn
Sendo assim, assinale a opção correta.
I. X(g)+e–→ X (g)+E1 II. X (g)+E2→X(g)+e- III. X(g)+E3→ X+(g)+e- IV. X+ (g)+E4→X2+ (g)+e-
Com base nas equações representadas, pode-se afirmar que:
Pb(s) + PbO2(s) + 2H2SO4(aq) → 2Pb2+ SO4 2- (aq) + 2H2O(ℓ)
São feitas as seguintes comparações sobre as capacidades caloríficas de diferentes substâncias puras, todas à temperatura ambiente:
I. A capacidade calorífica da água é menor que a do peróxido de hidrogênio.
II. A capacidade calorífica do bromo é menor que a do tetracloreto de carbono.
III. A capacidade calorífica do metanol é menor que a do mercúrio.
Assinale a opção que apresenta(s) comparação(ões) CORRETA(S).
É de 0,76 V a força eletromotriz padrão, E°, de uma célula eletroquímica, conforme a reação
Zn(s) + 2H+ (aq) → Zn2+ (aq) + H2 (g).
A análise dos dados termodinâmicos de reações permite a previsão da espontaneidade. Na tabela a seguir estão apresentados os dados termodinâmicos de duas reações químicas.
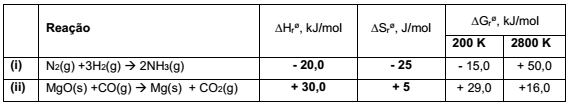
A partir dos dados apresentados, identifique as seguintes afirmativas como verdadeiras (V) ou falsas (F):
( ) A diminuição da temperatura desfavorece a espontaneidade da reação (i).
( ) O aumento da temperatura favorece a espontaneidade da reação (ii).
( ) Na temperatura de 400 K, a reação (i) será espontânea.
( ) Na temperatura de 4000 K, a reação (ii) será espontânea.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
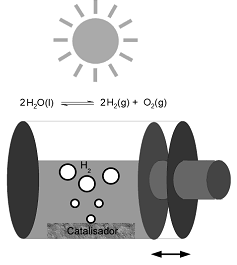
Recentemente, a produção fotocatalítica de hidrogênio vem atraindo atenção devido ao processo que gera um combustível limpo, o qual é utilizado em células a combustível. O processo se baseia na separação da água nos seus componentes, conforme equilíbrio inserido no esquema, utilizando luz solar e um fotocatalisador (p. ex. NaTaO3:La). O processo é extremamente endotérmico, necessitando 1,23 eV para ocorrer. Num experimento, o processo foi realizado num sistema fechado, como esquematizado abaixo. Considerando essas informações, identifique as afirmativas a seguir como verdadeiras (V) ou falsas (F):
( ) A quantidade de fotocatalisador limita a conversão.
( ) O aumento da temperatura irá favorecer a conversão.
( ) A diminuição do volume do sistema irá favorecer a conversão.
( ) É condição necessária para a produção de hidrogênio que o fotocatalisador absorva energia solar superior a 1,23 eV.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Águas termais, exploradas em diversos destinos turísticos, brotam naturalmente em fendas rochosas. O aquecimentonatural dessas águas, na sua grande maioria, deve-se ao calor liberado em processos radioativos de elementospresentes nos minerais rochosos que são transferidos para a água no fluxo pelas fendas. O gás radônio (222Rn) é oprovável responsável pelo aquecimento de diversas águas termais no Brasil. O 222Rn se origina do rádio (226Ra), nasérie do urânio (238U), naturalmente presente em granitos. O tempo de meia vida (t1/2) do 222Rn é de 3,8 dias, e esse seconverte em polônio (218Po), que por sua vez possui um t1/2 de 3,1 minutos. Considerando as informações dadas,considere as seguintes afirmativas:
1. A conversão de 222Rn em 218Po é um processo exotérmico.
2. A conversão de 226Ra em 222Rn emite quatro partículas β-.
3. Na série de decaimento, do 238U ao 218Po, cinco partículas α são emitidas.
4. Após 3,8 dias da extração da água termal, a concentração de 218Po atingirá a metade do valor da concentraçãoinicial de 222Rn.
Assinale a alternativa correta
1a Etapa: o composto A (C7H6O) sofre oxidação em solução básica de permanganato de potássio. O produto gerado, após neutralizado, é o ácido benzoico;
2a Etapa: o ácido benzoico reage com etanol em solução ácida, produzindo o composto B e água;
3a Etapa: o composto B sofre forte redução com hidreto de lítio-alumínio em éter, gerando dois produtos que, depois de neutralizados, formam então o composto C e o etanol.
Considerando as etapas supracitadas, são feitas as seguintes afirmações:
I) o composto A e o composto C são isômeros.
II) o composto B é um éster.
III) o composto B é o acetato de benzila.
Com base na análise das afirmações acima, assinale a opção correta.
As equações que representam as semirreações de cada espécie e os respectivos potenciais- padrão de redução (25 ºC e 1 atm) são apresentadas a seguir.
Zn2+(aq) + 2 e- → Zn (s) Eo = - 0,76 V
Ag+ (aq) + 1 e- → Ag (s) Eo = + 0,80 V
Com base nas informações apresentadas são feitas as afirmativas abaixo.
I – No eletrodo de zinco ocorre o processo químico de oxidação.
II – O cátodo da pilha será o eletrodo de prata.
III – Ocorre o desgaste da placa de zinco devido ao processo químico de redução do zinco.
IV – O sentido espontâneo do processo será Zn+2 + 2 Ago → Zno + 2 Ag+
V – Entre os eletrodos de zinco e prata existe uma diferença de potencial padrão de 1,56 V.
Estão corretas apenas as afirmativas