Questões Militares
Sobre transformações químicas e energia em química
Foram encontradas 365 questões
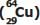 é de apenas 12,8 horas, pois ele sofre decaimento β se transformando em zinco, conforme a representação
é de apenas 12,8 horas, pois ele sofre decaimento β se transformando em zinco, conforme a representação  .
. Considerando uma amostra inicial de 128 mg de cobre-64, após 76,8 horas, a massa restante desse radioisótopo será de:
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
Dados:
Energia de Ligação
C = O 745 kJ/mol
C
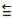 O 1080 kJ/mol
O 1080 kJ/mol C - Cl 328 kJ/mol
Cl - Cl 243 kJ/mol
Sobre o incidente do meteoro russo, assinale a alternativa correta:
Sobre a fumaça que anuncia a escolha do papa, assinale a alternativa correta:
Considerando que o saco plástico e o ar em seu interior formam o sistema observado e que o ar comporta-se como um gás ideal, o aluno descreveu as seguintes conclusões: I – Antes de atingir o volume máximo do saco plástico, a variação da energia interna do sistema é nula. II – O trabalho realizado pelo sistema é igual a zero. III – Trata-se de um sistema adiabático. IV – Devido ao aumento do volume do saco plástico, deduz-se que a massa de ar no interior do saco também aumentou.
Julgue se as conclusões do aluno são verdadeiras (V) ou falsas (F) e assinale a alternativa correta:
“Um relatório médico obtido com exclusividade pela redetelevisiva Al Jazeera aponta que foram encontrados níveis de polônio radiativo ao menos 18 vezes acima do normal nos restos mortais do líder palestino Yasser Arafat [...]. O isótopo de Polônio-210 não apresenta risco para a saúde humana se estiver fora do corpo. Caso ingerido ou inalado, mesmo em pequenas quantidades como 0,1 microgramas se tornam fatais”.
Fonte: <http://www1.folha.uol.com.br/mundo/2013/11/1367608-relatorio-de-medico-suicos-aponta-morte-de-yasser-arafat-por-envenenamento.shtml>. Acesso em: 13.março.2014.
Elementos radiativos podem ser bem aplicados,
tais como obtenção de imagens de radiografia,
tratamento de doenças, análises de materiais, usinas
termonucleares, entre outras aplicações. Dos
elementos listados, assinale o elemento que não é
radioativo:
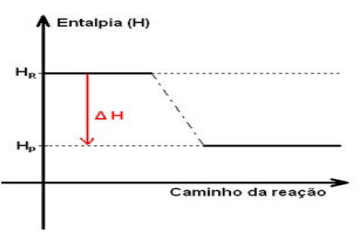
De acordo com o gráfico acima pode concluir se que trata se de uma reação Hp = 250, Hr = 480: I - Espontânea. II - Exotérmica, pois ocorreu um ganho de energia. III - Necessita apenas de um estímulo para que ocorra. IV - Sendo o Hp = 250 kj e Hr = 480kj o delta será de +130 kj. V - Endotérmica, pois ocorreu uma perda de energia. VI - Sendo o Hp = 250 e Hr = 480 delta H será de -130kj. Estão incorretas:
Realiza-se a eletrólise de uma solução aquosa diluída de ácido sulfúrico com eletrodos inertes durante 10 minutos. Determine a corrente elétrica média aplicada, sabendo-se que foram produzidos no catodo 300 mL de hidrogênio, coletados a uma pressão total de 0,54 atm sobre a água, à temperatura de 300 K.
Considere:
• Pressão de vapor da água a 300 K = 0,060 atm;
• Constante de Faraday: 1 F = 96500 C.mol–1;
• Constante universal dos gases perfeitos: R = 0,08 atm.L.K–1.mol–1
.
Considere uma célula a combustível alcalina (hidrogênio-oxigênio) sobre a qual são feitas as seguintes afirmações:
I. Sob condição de consumo de carga elétrica, a voltagem efetiva de serviço desse dispositivo eletroquímico é menor que a força eletromotriz da célula.
II. O combustível (hidrogênio gasoso) é injetado no compartimento do anodo e um fluxo de oxigênio gasoso alimenta o catodo dessa célula eletroquímica.
III. Sendo o potencial padrão dessa célula galvânica igual a 1,229 VEPH (volt na escala padrão do hidrogênio), a variação de energia livre de Gibbs padrão (∆G°) da reação global do sistema redox atuante é igual a − 237,2 kJ ∙ mol−1.
Das afirmações acima, está(ão) CORRETA(S) apenas
São feitas as seguintes afirmações sobre o que Joule demonstrou em seus experimentos do século XIX:
I. A relação entre calor e trabalho é fixa.
II. Existe um equivalente mecânico do calor.
III. O calor pode ser medido.
Das afirmações acima, está(ão) CORRETA(S) apenas
Substância Massa específica (g ∙ cm−3) Calor específico (J ∙ g−1 ∙ K−1)
H2O 1,00 4,18
Ti 4,54 0,52
Cr 7,18 0,45
Ni 8,90 0,44
As pilhas ou baterias que possuem o lítio como principal constituinte têm como uma de suas características o fato de serem leves, pois o lítio é o metal menos denso descoberto até o momento.
Considere as semi-reações: Li (s) +1 + e-
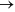 Li (s) E0 = -3, 05 V
Ag(aq)+1 + e-
Li (s) E0 = -3, 05 V
Ag(aq)+1 + e- 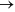 Ag (aq) E0 = +0,80 V
Ag (aq) E0 = +0,80 V
Se uma pilha é composta pelos dois elementos químicos acima, pode-se afirmar que o elemento que constitui o ânodo da reação eletroquímica espontânea e o Potencial da pilha são dados, respectivamente, por:
Baseando-se nos potenciais padrão de redução das semi-reações a seguir, são feitas as seguintes afirmativas:
Sn 2+ (aq) + 2 e- → Sn (s) E0 red = - 0,14 V
Li+ (aq) + 1 e- → Li (s) E0 red = - 3,04 V
I-O estanho cede elétrons para o lítio.
II-O eletrodo de estanho funciona como cátodo da pilha.
III-A reação global é representada pela equação: 2 Li0 (s)+ Sn2+ (aq) → Sn0 (s) + 2 Li+ (aq)
IV-No eletrodo de estanho ocorre oxidação.
V-A diferença de potencial teórica da pilha é de 2,90 V, (∆E = + 2,90 V).
Das afirmativas apresentadas estão corretas apenas:
Quando a temperatura cai, o reluzente estanho metálico exposto ao oxigênio do ar começa a se tornar friável e a se esboroar (desfazer) num pó acinzentado e não metálico - continua sendo estanho, mas com forma estrutural diferente”. (Adaptado de Os Botões de Napoleão - Penny Le Couteur e Jay Burreson - Pag 8).
I – o texto faz alusão estritamente a ocorrência de fenômenos físicos.
II – o texto faz alusão a ocorrência de uma reação de oxidação do estanho do botão.
III – o texto faz alusão a ocorrência de uma reação de síntese.
IV – o texto faz alusão a ocorrência de uma reação sem transferência de elétrons entre espécies estanho metálico e o oxigênio do ar.
Das afirmativas apresentadas estão corretas apenas: