Questões Militares
Sobre transformações químicas e energia em química
Foram encontradas 365 questões
Um isótopo radioativo de Urânio-238 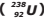 , de número atômico 92 e número de massa 238,
emite uma partícula alfa, transformando-se num átomo X, o qual emite uma partícula beta, produzindo
um átomo Z, que por sua vez emite uma partícula beta, transformando-se num átomo M. Um
estudante analisando essas situações faz as seguintes observações:
, de número atômico 92 e número de massa 238,
emite uma partícula alfa, transformando-se num átomo X, o qual emite uma partícula beta, produzindo
um átomo Z, que por sua vez emite uma partícula beta, transformando-se num átomo M. Um
estudante analisando essas situações faz as seguintes observações:
I – os átomos X e Z são isóbaros;
II – o átomo M é isótopo do Urânio-238 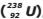
III – o átomo Z possui 143 nêutrons;
IV – o átomo X possui 90 prótons.
Das observações feitas, utilizando os dados acima, estão corretas:

II – a reação Zn2+(aq) + Cu º(s) ➞ Zn º(s) + Cu2+(aq) não é espontânea;
III – pode-se estocar, por tempo indeterminado, uma solução de nitrato de níquel II, em um recipiente revestido de zinco, sem danificá-lo, pois não haverá reação entre a solução estocada e o revestimento de zinco do recipiente;
IV – a força eletromotriz de uma pilha eletroquímica formada por chumbo e magnésio é 2,24 V;
V – uma pilha eletroquímica montada com eletrodos de cobre e prata possui a equação global: 2 Ag+ (aq) + Cuº(s) ➞ 2 Agº(s) + Cu2+ (aq) .
DADOS:
Constante de Faraday= 96500 Coulombs/mol de elétrons
Massa molar do níquel=59 g/mol
Massa molar da prata=108 g/mol

Esse conjunto de cubas em série é ligado a uma bateria
durante um certo intervalo de tempo, sendo observado
um incremento de 54 g de massa de prata em um dos
eletrodos de prata. Desse modo, o incremento da massa
de níquel em um dos eletrodos de níquel é de
Dada a seguinte equação iônica de oxidorredução da reação, usualmente utilizada em etapas de sínteses químicas, envolvendo o íon dicromato (Cr2O72-) e o ácido oxálico (H2C2O4):
Cr2O72- + H2C2O4 + H+→ + Cr3+ + CO2 + H2O
Considerando a equação acima e o balanceamento de equações químicas por oxidorredução,
a soma total dos coeficientes mínimos e inteiros obtidos das espécies envolvidas e a substância
que atua como agente redutor são, respectivamente,
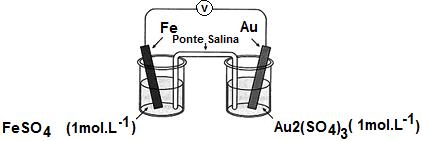
Dados:
Fe2+ (aq) + 2e ? Fe (s) E0 = - 0,44 V
Au3+ (aq) + 3e ? Au(s) E0 = + 1,50 V
Assinale a alternativa correta
Bebidas especialmente ingeridas por esportistas têm representado importante fatia de consumo. Tais bebidas são soluções isotônicas repositoras hidroeletrolíticas e, portanto, auxiliam na manutenção e preparação física de atletas de todas as modalidades. A seguir, reproduz-se parte da tabela nutricional constante no rótulo de uma dessas bebidas.

A partir dessas informações e considerando os múltiplos aspectos que
elas suscitam, julgue o item subsequente.
Por serem soluções eletrolíticas, as referidas bebidas conduzem
corrente elétrica.
Embora o peróxido de hidrogênio (H2O2) não seja considerado um radical livre, ele é responsável, direta ou indiretamente, por diversas patologias. Em termos químicos, esse óxido é fracamente reativo, porém exerce papel deletério no organismo, por ser capaz de transpor facilmente membranas celulares e gerar o radical hidroxil (•OH), seja por meio de exposição à luz ultravioleta (equação I), seja por interação com metais de transição, como o ferro, por meio do processo conhecido como reação de fenton (equação II).

Considerando as informações acima, julgue o item a seguir.
Na reação de fenton, o peróxido de hidrogênio atua como agente
oxidante.
Observe o gráfico a seguir.
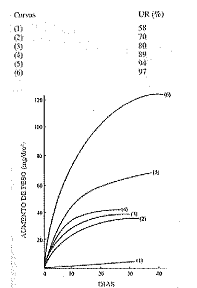
O gráfico acima evidencia a influência de deposição de partículas de NaCl em superfícies de ferro, em diferentes valores de umidade relativa.
Analisando o gráfico, é correto afirmar que
Coloque F (falso) ou V (verdadeiro)nas afirmativas abaixo, em relação à potenciometria, assinalando, a seguir, a opção correta.
I - Potenciometria é uma aplicação analítica direta da equação de Nernst, medindo-se os potenciais de elétrodos polarizados em condições de corrente zero.
II - A equação de Nernst fornece uma relação simples entre o potencial relativo de um elétrodo e a concentração das espécies iônicas correspondentes em solução.
III- O mais importante elétrodo sensível ao pH é o elétrodo de vidro. Esse dispositivo se baseia no fato de membranas delgadas de certas variedades de vidro serem suscetíveis aos íons-hidrogênio.
Um sistema com volume de 25 litros absorve 1 KJ de calor. Qual a variação de energia quando o sistema se expande para um volume de 29 litros, contra uma pressão constante externa de 1 atm?
Considere:
calor absorvido pelo sistema (+ ) ;
Calor perdido pelo sistema (-) ;
Trabalho realizado pelo sistema (-) ;
Trabalho realizado sobre o sistema (+ ) ; e
1 l.atm = 100 J
Calcule a entalpia padrão de combustão de glicose, e assinale a opção correta.
Dados:
C6H12O6 (s) ΔH formação = -1268 KJ/mol
CO2 (g) ΔH formação = -393 KJ/mol
H2O (1) ΔH formação = -286 KJ/mol
Em relação às atmosferas corrosivas, analise as afirmativas abaixo.
I - O dióxido de enxofre e o trióxido de enxofre são os mais frequentes constituintes corrosivos de atmosferas industriais urbanas.
II - A deposição de material não metálico como sílica (SiO2), sob forma de poeira, cria condições de proteção ao material metálico.
III- A ação corrosiva da atmosfera independe da temperatura.
IV - O ozônio é prejudicial para elastômeros, como a borracha, que, sob ações prolongadas desse gás, sofre oxidação, perdendo elasticidade.
Assinale a opção correta.
Analise as afirmativas abaixo, em relação à proteção anódica.
I - Na proteção anódica, há uma uniforme distribuição de densidade de corrente, necessitando-se apenas de um só catodo auxiliar para proteger longos trechos.
II - A proteção anódica não pode ser utilizada em meios fortemente corrosivos.
III- Na proteção anódica, a variável de controle é o potencial estrutura-meio, o qual é variado até chegar-se ao valor desejado, sendo a intensidade da corrente elétrica uma consequência do potencial aplicado.
Assinale a opção correta.
