Questões Militares
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 306 questões
A notícia publicada neste ano trata de um projeto de mineração de potássio. Sobre esse elemento, analise as afirmativas a seguir:
1. É um metal.
2. Soluções salinas de seus haletos costumam ser levemente alcalinas.
3. Na mineração, é extraído como substância simples de águas de lagos e rios.
4. Sua principal aplicação é em fertilizantes, onde é o terceiro macronutriente da sigla NPK.
Assinale a alternativa correta.
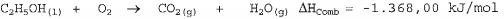
Sabendo-se que na combustão de certa quantidade de etanol houve a liberação de 456,00 kJ, é correto afirmar que a quantidade de oxigênio consumida na reação foi de:
Dado: Carga formal = V - (L - 0,5.B)
V - n° de elétrons de valência
L - n° de elétrons presentes em pares isolados
B - n° de elétrons compartilhados
"Nos elementos da família lA observa-se que, ao dirigir-se do Lítio(Li) para o Frâncio(Fr), a primeira energia de ionização dos elementos ___________ , pois a distância entre a camada de valência e o núcleo . "
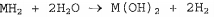
Qual elemento químico pode substituir a incógnita M da reação acima, de modo que sua camada de valência seja completamente preenchida?
CH4(g) + 2 O2(g) ->CO2(g) + 2 H2O(g) ΔH = -802 kJ
Se utilizarmos 4 mol de CH4 e 4 mol de O2 para uma nova reação, a quantidade de calor liberada será de
I - Os átomos de um mesmo elemento químico não precisam apresentar o número de nêutrons em comum.
II - Para que um átomo neutro do elemento químico Ferro transforme-se no íon Fe2+ , ele deve perder 2 elétrons.
III - O Diagrama de Pauling apresenta a posição dos elétrons na eletrosfera.
Está(ão) CORRETO(S):
Quando a temperatura cai, o reluzente estanho metálico exposto ao oxigênio do ar começa a se tornar friável e a se esboroar (desfazer) num pó acinzentado e não metálico - continua sendo estanho, mas com forma estrutural diferente”. (Adaptado de Os Botões de Napoleão - Penny Le Couteur e Jay Burreson - Pag 8).
I – o texto faz alusão estritamente a ocorrência de fenômenos físicos.
II – o texto faz alusão a ocorrência de uma reação de oxidação do estanho do botão.
III – o texto faz alusão a ocorrência de uma reação de síntese.
IV – o texto faz alusão a ocorrência de uma reação sem transferência de elétrons entre espécies estanho metálico e o oxigênio do ar.
Das afirmativas apresentadas estão corretas apenas:
Dados:
Massas Atômicas: C = 12 u; O = 16 u e H = 1u;
Volume molar nas condições padrão=24,5 L·mol-1 .
Baseado nessa reação, são feitas as seguintes afirmativas:
I – O sódio atua nessa reação como agente redutor.
II – A soma dos menores coeficientes inteiros que balanceiam corretamente a equação é 7.
III – Os dois produtos podem ser classificados como substâncias simples.
IV – Essa é uma reação de deslocamento.
Das afirmativas feitas, estão corretas:
2 Al (s) + Fe2O3
 (s) 2 Fe (s) + Al2O3
(s) 2 Fe (s) + Al2O3(s) + calor
Reação de Termita
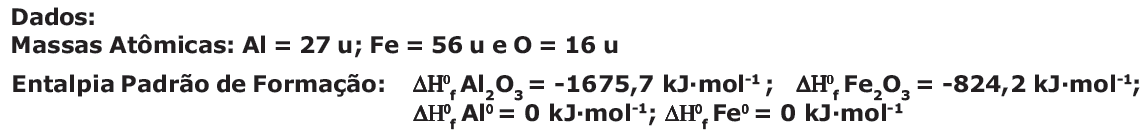
Em relação à composição química elementar da madeira, pode-se afirmar que não há diferenças consideráveis, levando-se em conta as madeiras de diversas espécies. Os principais elementos existentes são: Carbono (C)48%, Hidrogênio (H)6%, Oxigênio (O) 44% e Nitrogênio (N) 1%; além destes elementos encontram-se pequenas quantidades de cálcio (Ca), potássio (K), magnésio (Mg) e outros, constituindo as substâncias minerais existentes na madeira.
Em um churrasco realizado por um certo gaúcho, em sua residência, foi consumido 1,7 Kg de madeira para assar toda a carne. Supondo que a combustão do carbono seja completa, a quantidade em matéria (mol) formada de gás carbônico será:
Dados: C=12g/mol.