Questões Militares
Sobre transformações químicas em química
Foram encontradas 474 questões
Sobre a tabela periódica, analise as afirmativas a seguir.
I. Os elementos químicos estão dispostos em ordem crescente dos números atômicos.
II. As linhas horizontais são as Famílias.
III. As propriedades químicas estão ligadas à distribuição eletrônica do elemento.
IV. Os elementos da Família 3 A são metais.
Está(ão) correta(s) apenas a(s) afirmativa(s)
Em muitos aspectos, os gases são a forma de matéria mais facilmente entendida. Ainda que diferentes gases possam ter diferentes propriedades químicas, eles se comportam de maneira bastante similar no que concerne às propriedades físicas. De acordo com o exposto, analise as afirmativas a seguir.
I. A densidade do vapor de tetracloreto de carbono a 714 torr e 125°C é 4,43 g/L.
II. A razão entre as taxas de efusão de N2 e O2 é 0,93.
III. A velocidade vqm, u, de uma molécula de N2 a 25°C é 5,15 x 102 m/s.
Está(ão) correta(s) apenas a(s) afirmativa(s)
Moléculas de lítio não existem no estado líquido ou sólido, mas, sem dúvida, as moléculas diatômicas são encontradas no lítio gasoso. A energia de ligação do Li2 é 105 kJ/mol.
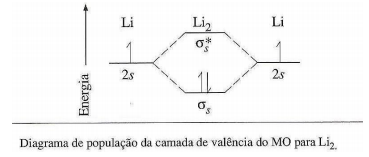
Sobre o diagrama de população da camada de valência do MO para Li2, analise as afirmativas a seguir.
I. A ordem de ligação é 1/2.
II. A configuração eletrônica de Li2 pode ser escrita como KK (σs)2 .
III. A energia de ligação do Li2 é menor do que H2 porque há uma blindagem do núcleo pela camada K completa de cada átomo.
Está(ão) correta(s) apenas a(s) afirmativa(s)
CONSTANTES

DEFINIÇÕES


Considere as seguintes proposições para espécies químicas no estado gasoso:
I. A energia de ionização do íon Be3+ é maior do que a do íon He+ .
II. O momento dipolar elétrico total da molécula de XeF4 é maior do que o da molécula de XeF2.
III. A energia necessária para quebrar a molécula de F2 é maior do que a energia necessária para quebrar a molécula de O2.
IV. A energia do orbital 2s do átomo de berílio é igual à energia do orbital 2s do átomo de boro.
Das proposições acima, está(ão) CORRETA(S)
CONSTANTES

DEFINIÇÕES


CONSTANTES

DEFINIÇÕES


CONSTANTES

DEFINIÇÕES