Questões Militares
Sobre transformações químicas em química
Foram encontradas 474 questões
As moléculas ΦOF4, ΨF4 e ΩF5 apresentam, respectivamente, formas geométricas que se aproximam das figuras (1), (2) e (3), mostradas a seguir, no modelo de bola e palito:
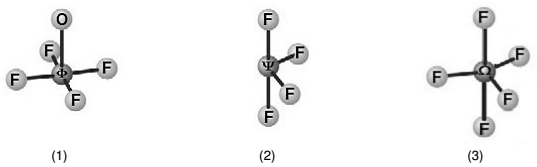
Sabendo-se que “Φ“, “Ψ” e “Ω” representam elementos da tabela periódica, assinale a alternativa correta que indica, na sequência, as possíveis identidades destes elementos:
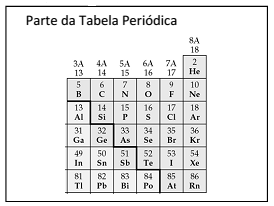
No esboço da Tabela Periódica abaixo estão discriminados os números de nêutrons dos isótopos mais estáveis de alguns elementos.
Considere agora um composto iônico binário, em que:
(i) o cátion, de carga +2, possui 12 prótons;
(ii) o ânion, de carga –3, possui 10 elétrons.
A massa de 1 mol deste composto é aproximadamente igual a:
O suor humano apresenta quantidades razoáveis de cloreto de sódio. Há, também , traços de ácido lático, entre outras substâncias. Quando tocamos algum objeto, deixamos nele nossas impressões digitais, que são impregnadas de suor e, portanto , impregnadas de cloreto de sódio. Para visualizar essas impressões, uma das maneiras é borrifar uma solução de nitrato de prata nos objetos analisados. Isso leva à formação de precipitado de cloreto de prata (reação I) que, por posterior fotólise, leva à formação de prata metálica, que revela as linhas da impressão digital na form a de um sólido de cor prateada (reação II). Observe as reações abaixo:
I: NaCl(s) + AgNO3(aq) → NaNO3(aq) + AgCl(s)
II: 2AgCl(s) → 2 Ag(s) + Cl2(g)
As reações apresentadas são classificadas, respectivamente, como:
Os átomos de um elemento Z cujo número atômico é 20 se unem com os átomos de um elemento Y cujo número atômico é 7 através de uma ligação iônica. Qual a fórmula do composto formado por esses dois elementos?
A idéia do átomo surgiu com Demócrito a cerca de 450 a.C, que dizia que a matéria era indivisível.
Essa teoria no entanto ganhou força a partir do Século XVIII com a primeira descrição de modelo atômico proposta por Dalton cuja teoria ganhou um nome, e sua descrição propunha que:
Em relação à estrutura atômica, observe as espécies de I a IV, representadas a seguir:
I - 10 prótons, 10 nêutrons, 10 elétrons.
II - 09 prótons, 10 nêutrons, 10 elétrons.
III- 10 prótons, 09 nêutrons, 10 elétrons.
IV - 10 prótons, 10 nêutrons, 11 elétrons.
Assinale a opção cujas espécies apresentam íons.
O fósforo elementar é, industrialmente, obtido pelo aquecimento do fosfato de cálcio com coque na presença de sílica de acordo com as seguintes reações:
2 Ca3 (PO4) 2 + 6 SiO2 → 6 CaSiO3 + P4O10
P4O10 + 10 C → P4 + 10 CO
Calcule quantos gramas de fosfato de cálcio são necessários
para produzir 46,5 g de fósforo elementar, e assinale a
opção correta.
Os aceleradores de partículas são equipamentos que fornecem energia a feixes de partículas subatômicas eletricamente carregadas. Todos os aceleradores de partículas possibilitam a concentração de alta energia em pequeno volume e em posições arbitradas e controladas de forma precisa. Exemplos comuns de aceleradores de partículas existem nas televisões e geradores de raios-X, na produção de isótopos radioativos, na radioterapia do câncer, na radiografia de alta potência para uso industrial e na polimerização de plásticos.
(Fonte: http://www.explicatorium.com/Acelerador-particulas.php Acesso em : 26/102012)
Dentre as partículas subatômicas, aquela que apresenta carga negativa é denominada:
Observe as reações abaixo.
I - X2 + H2 → 2HX
II - 3X2 + S → SX6
III - X2 + H20 → H+ + X- + HOX
Considerando o elemento X das reações acima como um halogênio, é correto afirmar que: