Questões Militares
Sobre transformações químicas em química
Foram encontradas 475 questões
Quanto à ordenação dos elementos na tabela e ao significado da característica que determina sua posição, é correto afirmar que a organização se dá em ordem:
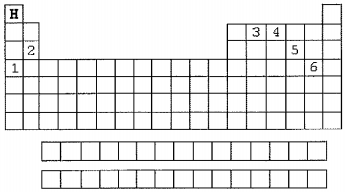
Analise as afirmativas abaixo referentes a esse esboço.
I - O elemento representado por 5 apresenta variantes alotrópicas quando forma moléculas de substâncias compostas.
II - A quantidade de elétrons que o elemento representado por 1 ganha é a mesma que aquele representado por 6 perde quando ambos sofrem ionização.
III- O elemento representado por 3 forma ligações covalentes quando se liga ao hidrogênio.
IV - O elemento indicado por 4 forma a substância simples mais abundante na atmosfera terrestre, e o elemento indicado por 2 faz parte da composição dos ossos humanos.
Assinale a opção correta.
Para uma molécula diatômica, a energia potencial em função da distância internuclear é representada pela figura ao lado. As linhas horizontais representam os níveis de energia vibracional quanticamente permitidos para uma molécula diatômica. Uma amostra contendo um mol de moléculas diatômicas idênticas, na forma de um sólido cristalino, pode ser modelada como um conjunto de osciladores para os quais a energia potencial também pode ser representada qualitativamente pela figura. Em relação a este sólido cristalino, são feitas as seguintes proposições:
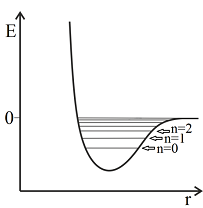
I. À temperatura de 0 K, a maioria dos osciladores estará estado vibracional fundamental, cujo número quântico vibracional, n, é igual a zero.
II. À temperatura de 0 K, todos os osciladores estarão no estado vibracional fundamental, cujo número quântico vibracional, n, é igual a zero.
III. O movimento vibracional cessa a 0 K.
IV. O movimento vibracional não cessa a 0 K.
V. O princípio de incerteza de Heisenberg será violado se o movimento vibracional cessar.
Das proposições acima estão CORRETAS
“Gelo de fogo” escondido em permafrost é fonte de energia do futuro? Conhecido como "gelo que arde", o hidrato de metano consiste em cristais de gelo com gás preso em seu interior. Eles são formados a partir de uma combinação de temperaturas baixas e pressão elevada e são encontrados no limite das plataformas continentais, onde o leito marinho entra em súbito declive até chegar ao fundo do oceano. Acredita-se que as reservas dessa substância sejam gigantescas. A estimativa é de que haja mais energia armazenada em hidrato de metano do que na soma de todo petróleo, gás e carvão do mundo. Ao reduzir a pressão ou elevar a temperatura, a substância simplesmente se quebra em água e metano – muito metano. Um metro cúbico do composto libera cerca de 160 metros cúbicos de gás a pressão e temperatura ambiente, o que o torna uma fonte de energia altamente intensiva.
Disponível em: http://www.bbc.co.uk/portuguese/noticias/2014/04/140421_energia_metano_ms.shtml.
Acessado em 21/04/2014. Texto adaptado.
Dado: R = 8,2 x 10-5 m3 atm K-1 mol-1
Para armazenar todo o gás do interior de 1 m3 de “gelo de fogo” num cilindro de 1 m3 e a temperatura de 0°C, é necessária uma pressão (em atm) de
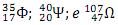
marque a alternativa correta, considerando-se as condições de 1 atm e 25 ?.
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a
Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro
preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro
(Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2 (g) COCl2 (g).
O texto a seguir serve como base para a resolução da questão.
O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro (Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2(g) → COCl2 (g).
Em um reator foram dispostos 560 g de monóxido de carbono e 355 g de cloro. Admitindo-se a reação entre o monóxido de carbono e o cloro com rendimento de 100 % da reação e as limitações de reagentes, a massa de fosgênio produzida é de
Dados:
- massas atômicas: C = 12 u ; Cl = 35,5 u; O = 16 u
Abaixo é mostrada a reação entre essas duas substâncias.
Al2(SO4)3 + 3 Ca(OH)2
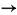 2 Al(OH)3 + 3 CaSO4
2 Al(OH)3 + 3 CaSO4Como pode ser classificada essa reação?
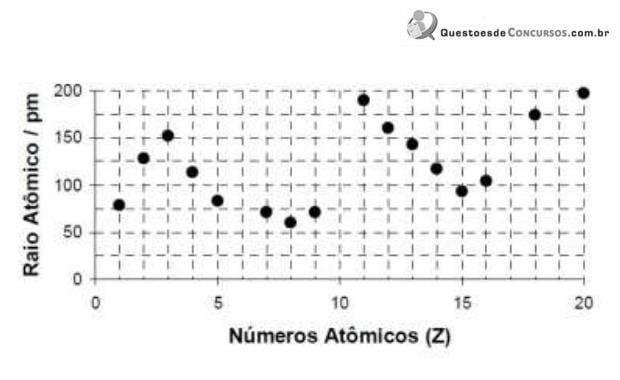
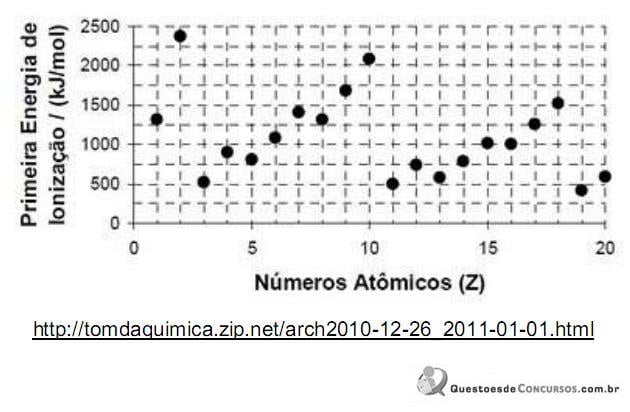
A explicação para o fato de a primeira energia de ionização do elemento sódio ser menor do que a do elemento fósforo é:
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.

Considere que esse polímero seja formado a partir dos monômeros 1 e 2 abaixo representados, os quais podem ser obtidos a partir do benzeno, por meio de uma série de reações.

Na combustão completa de 1 mol do monômero 2, a quantidade de água formada é igual a 1 mol.
Com base nessas informações, julgue os itens que se seguem, considerando que as massas molares do N, do H e do O sejam iguais a 14, 1 e 16 g/mol, respectivamente.
A reação de decomposição do NH4NO3 (s) está corretamente balanceada na equação 8NH4NO3 (s) → 4NH3 + 8N2O (g) + 4NO2 (g) + 10H2O (l) + O2 (g).
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Entre os metais citados no texto, aquele que apresenta maior energia de ionização é o alumínio.