Questões Militares
Sobre transformações químicas em química
Foram encontradas 475 questões
Dadas as reações:
PCl3 + 3H2O → H3PO3 + 3HCl
PCl5 + 4H2O → H3PO4 + 5HCl
Assinale a afirmativa correta:
São dadas as seguintes afirmativas:
I – Joseph J. Thomson, em seu modelo atômico, descrevia o átomo como uma estrutura na qual a carga positiva permanecia no centro, constituindo o núcleo, enquanto as cargas negativas giravam em torno desse núcleo;
II – um átomo, no estado fundamental, que possui 20 elétrons na sua eletrosfera, ao perder dois elétrons, gerará um cátion bivalente correspondente, com configuração eletrônica – segundo o diagrama de Linus Pauling – igual a 1s2 2s2 2p6 3s2 3p6;
III – a afinidade eletrônica (eletroafinidade) aumenta conforme o raio atômico diminui. Dessa forma, devido ao seu menor raio atômico, o oxigênio (Z=8) possui maior afinidade eletrônica do que o enxofre (Z=16), ambos pertencentes à mesma família da Tabela Periódica;
IV – o raio de um íon negativo (ânion) é sempre menor que o raio do átomo que lhe deu origem.
Das afirmações feitas, utilizando os dados acima, estão corretas apenas:
O etino, também conhecido como acetileno, é um alcino muito importante na Química. Esse composto possui várias aplicações, dentre elas o uso como gás de maçarico oxiacetilênico, cuja chama azul atinge temperaturas em torno de 3000 °C.
A produção industrial do gás etino está representada, abaixo, em três etapas, conforme as equações balanceadas:

Considerando as etapas citadas e admitindo que o rendimento de cada etapa da obtenção do
gás etino por esse método é de 100 %, então a massa de carbonato de cálcio (CaCO3(s)) necessária para produzir 5,2 g do gás etino (C2H2(g)) é
Uma nova mania na Europa consiste em "consumir" oxigênio puro. As embalagens são latas exclusivas com inalador em forma de copo, são fabricadas na Suíça e contêm 99,5% de oxigênio. Basta pressionar o copo inalador contra a vasilha para liberar oxigênio e respirar.
Este sistema, chamado de OXYFIT, não é um sistema de liberação contínua do gãs, mas libera o oxigênio a cada inalação.
Consumido em alguns países da América do Norte e da Europa, este produto, chamado de Opur, é vendido em embalagens de 2 litros que contêm o equivalente a 10-15 inalações, em média. Mas há também versões de 5 e de 8 litros, esta última contendo 160 gramas do gãs. Os preços variam de US$ 10 a US$ 32 a garrafa.
Considerando os dados acima e sabendo que a massa molar do oxigênio (02) é igual a 32 g/mol, assinale a opção que apresenta corretamente o número de mols de gãs oxigênio, contidos numa embalagem de 8 litros de Opur, e a densidade do conteúdo, respectivamente.
O fosfato de cálcio, Ca3(PO4)2, ê um dos compostos utilizados recentemente em pesquisas na obtenção de cimento ortopédico. A reação entre o óxido de cálcio com ácido fosfórico é uma das formas de obtenção do Ca3(PO4)2.
Assinale a opção que representa a reação química balanceada
de obtenção do fosfato de cálcio a partir de óxido de cálcio
e ácido fosfórico.
I. O átomo A deve ter maior energia de ionização que o átomo B.
II. A distância da ligação entre os átomos na molécula A2 deve ser menor do que aquela na molécula B2.
III. A energia de ionização do elétron no orbital 1s do átomo A deve ser maior do que aquela do elétron no orbital 1s do átomo de hidrogênio.IV. A energia de ligação dos átomos na molécula B2 deve ser menor do que aquela dos átomos na molécula de hidrogênio (H2) .
Das afirmações acima está(ão) CORRETA(S) apenas
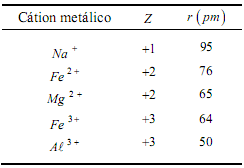
A tabela abaixo apresenta os números de cargas elétricas (Z) e o raio iônico (r) apresentados por alguns cátions metálicos.
Para as mesmas condições de temperatura e pressão é CORRETO afirmar que o pH de soluções aquosas, com concentração 1mol . L−1 dos nitratos de cada um dos cátions apresentados na tabela, aumenta na sequência:

19X39 20Y54 19Z40 17W37
Assinale a opção em que os átomos são isótopos.
Observe a tabela abaixo.

Os valores de Z (N° Atômico), A (N° de Massa), p+ (Prótons), e- (Elétrons) e n° (Nêutrons) do íon Potássio (K) carregado positivamente, na forma catiônica, e com carga elétrica igual a +1, são respectivamente:
Dados: N° estado fundamental o Potássio (K) possui N° Atômico = 19 e N° de Massa = 39.
