Questões Militares
Sobre transformações químicas em química
Foram encontradas 475 questões
A massa m de um isótopo radioativo que continua ativa em um instante t pode ser determinada pela expressão m = m0e–kt , em que k é a constante de decaimento radioativo, característica do isótopo, e m0, a massa ativa do isótopo no instante t = 0.
no início do ano, foi detectada a contaminação do solo, da água e
até de alimentos com isótopos radioativos, como iodo-131 e césio-
137. Sabendo que o iodo-131 emite radiação beta durante a sua
desintegração e tem meia-vida de 8 dias, julgue o seguinte item.
testar o nível de radônio-222 em residências, em razão de esse gás
pertencer à série de desintegração do urânio-238, elemento
presente, em grande quantidade, no subsolo daquele país. Com base
nessas informações, julgue o item subsequente.

fundido e que, no processo, além do Na(s), também se forma

julgue o item seguinte.

Com base nessas informações e considerando
 a variação de
a variação deentalpia padrão das reações a 25 ºC, julgue os itens a seguir.

Com base nessas informações e considerando
 a variação de
a variação deentalpia padrão das reações a 25 ºC, julgue os itens a seguir.
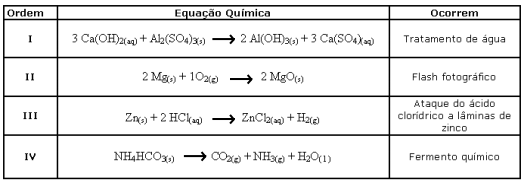
As equações químicas I, II, III e IV correspondem, nessa ordem, aos seguintes tipos de reação:
A composição química do cimento Portland, utilizado na construção civil, varia ligeiramente conforme o que está indicado na tabela abaixo:
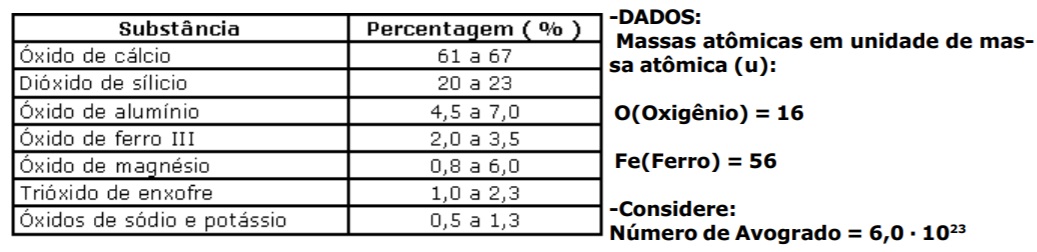
Assinale a alternativa correta:
I- 1s2 2s2 2p6
II- 1s2 2s2 2p6 3s1
III- 1s2 2s2 2p6 3s2
IV- 1s2 2s2 2p6 3s2 3p5
Com base nessas informações, a alternativa correta é:
Um laboratorista pesou separadamente uma amostra I, de hidróxido de sódio (NaOH), e uma amostra II, de óxido de cálcio (CaO), e, como não dispunha de etiquetas, anotou somente a soma das massas das amostras (I + II) igual a 11,2 g.
Cada uma das amostras I e II foi tratada separadamente com ácido sulfúrico (H 2SO4) produzindo, respectivamente, sulfato de sódio (Na2SO4) mais água (H2O) e sulfato de cálcio (CaSO4) mais água (H2O). Considere o rendimento das reações em questão igual a 100%.
Sendo a soma das massas dos sais produzidos (Na 2SO4 + CaSO4) igual a 25,37 g, então a massa da amostra I de hidróxido de sódio (NaOH) e a massa de amostra II de óxido de cálcio (CaO) são, respectivamente:
Dados:

4 C3H5(NO3)3(l) → 6 N2(g) + 12 CO(g) + 10 H2O(g) + 7 O2(g)
Considerando os gases acima como ideais, a temperatura de 300 Kelvin (K) e a pressão de 1 atm, o volume gasoso total que será produzido na detonação completa de 454 g de C3H5(NO3)3(l) é:
Dados:
Elemento H(hidrogênio) C( carbono) O ( Oxigênio) N( nitrogênio)
Massa 1 12 16 14
atômica(u)
Constante universal dos gases: R=8,2 · 10-2 atm · L · K-1 · mol-1
FeSO4(aq) + Ag(s) → não ocorre a reação
2 AgNO3(aq) + Fe(s) → Fe(NO3)2(aq) + 2 Ag(s)
3 Fe(SO4)(aq) + 2 Al(s) → Al2(SO4)3(aq) + 3 Fe(s)
Al2(SO4)3(aq) + Fe (s) → não ocorre a reação
De acordo com as reações acima equacionadas, a ordem decrescente de reatividade dos metais envolvidos em questão é:


