Questões Militares
Sobre transformações químicas em química
Foram encontradas 475 questões
I. A fusão do enxofre elementar,S8(s) produz moléculas S8
II. Sílica, (SiO2)n é um exemplo de sólido molecular.
III. A fusão da sílica, (SiO2)n, ocorre com quebra das ligações Si-O.
IV. Sólidos iônicos são bons condutores de eletricidade.
V. As partículas formadoras dos sólidos metálicos são átomos.
I. Obtenção do alumínio a partir da bauxita (Al2O3).
II. Obtenção de aluminio a partir da reciclagem de latinhas.
III. Obtenção de sacos plásticos a partir do eteno.
IV. Obtenção de pregos a partir de material enferrujado.
Dos processos citados, quais são os que representam reações químicas.
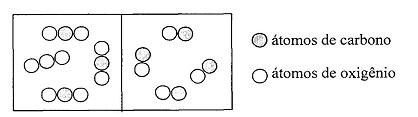
( ) O compartimento da esquerda contém mais elementos que o da direita.
( ) Os compartimentos contêm a mesma massa de carbono.
( ) A proporção de oxigênio para carbono é a mesma em ambos os compartimentos.
( ) As quantidades de matéria de cada gás são as mesmas em cada compartimento.
I - No modelo de Dalton, o átomo é dividido em prótons e elétrons.
II - No modelo de Rutherford, os átomos são constituídos por um núcleo muito pequeno e denso e carregado positivamente. Ao redor do núcleo estão distribuídos os elétrons, como plane- tas em torno do Sol.
III - O físico inglês Thomson afirma, em seu modelo atômico, que um elétron, ao passar de uma órbita para outra, absorve ou emite um quantum (fóton) de energia.
Das afirmações feitas, está(ão) correta(s)
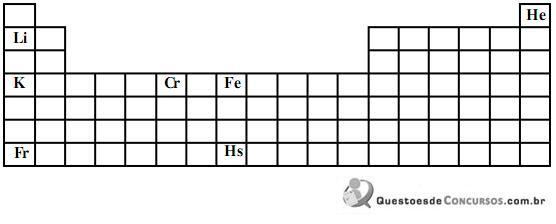
Sobre tais elementos químicos, assinale a alternativa correta.
Observação:
Adote a convenção de que o primeiro elétron a ocupar um orbital possui o número quântico de spin igual a -1/2.
I - O número atômico do ferro (Fe) é 26.
II - O nível/subnível 3d6 contém os elétrons mais energéticos do átomo de ferro (Fe), no estado fundamental.
III - O átomo de ferro (Fe), no nível/subnível 3d6, possui 3 elétrons desemparelhados, no estado fundamental.
IV - O átomo de ferro (Fe) possui 2 elétrons de valência no nível 4 (4s2), no estado fundamental.
Das afirmações feitas, está(ão) correta(s)
I - A configuração eletrônica, segundo o diagrama de Linus Pauling, do ânion trivalente de nitrogênio ( 7N3- ), que se origina do átomo nitrogênio, é 1s2 2 s2 2p6.
II - Num mesmo átomo, não existem dois elétrons com os quatro números quânticos iguais.
III - O íon
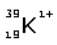 possui 19 nêutrons.
possui 19 nêutrons.IV - Os íons Fe2+ e Fe3+ do elemento químico ferro diferem somente quanto ao número de prótons.
Das afirmações feitas, está(ão) correta(s)
Etapa I S8(s) + O2(g) → SO2(g)
Etapa II SO2(g) + O2(g) → SO3(g)
Etapa III SO2(3) + H2O(l) → H2SO4(aq)
Considerando as etapas citadas e admitindo que o rendimento de cada etapa da obtenção do ácido sulfúrico por esse método é de 100%, então a massa de enxofre ( S8(s) ) necessária para produzir 49 g de ácido sulfúrico ( H2SO4(aq) ) é:


Admita a variação de concentração em mol por litro (mol·L-1) do monóxido de nitrogênio (NO) em função do tempo em segundos (s), conforme os dados, da tabela abaixo:
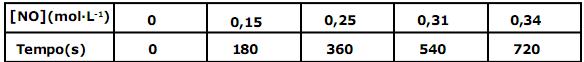
A velocidade média, em função do monóxido de nitrogênio (NO), e a velocidade média da reação acima representada, no intervalo de tempo de 6 a 9 minutos (min), são, respectivamente, em mol·L-1·min-1:
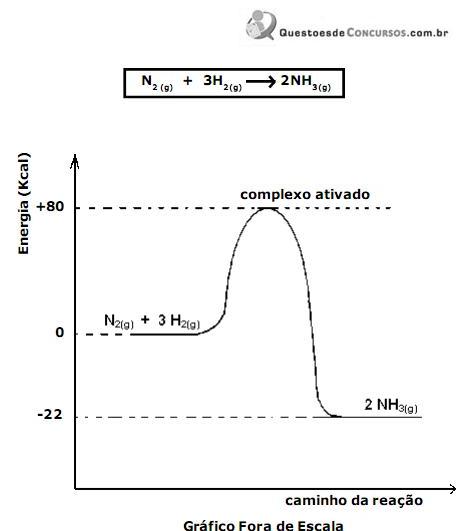
Relativo ao gráfico envolvendo essa reação e suas informações, são feitas as seguintes afirmações:
I - O valor da energia envolvida por um mol de NH3 formado é 22 kcal.
II - O valor da energia de ativação dessa reação é 80 kcal.
III - O processo que envolve a reação N2(g) + 3H2(g) → 2NH3(g) é endotérmico.
Das afirmações feitas, está(ão) correta(s)
Historicamente, a teoria atômica recebeu várias contribuições de cientistas.
Assinale a opção que apresenta, na ordem cronológica CORRETA, os nomes de cientistas que são apontados como autores de modelos atômicos.
