Questões Militares
Sobre transformações químicas em química
Foram encontradas 475 questões
Dada a seguinte equação iônica de oxidorredução:
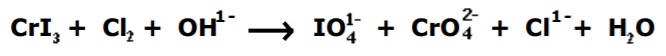
Considerando o balanceamento de equações químicas por oxidorredução, a soma total dos coeficientes mínimos e inteiros obtidos das espécies envolvidas e o(s) elemento(s) que sofrem oxidação, são, respectivamente,
Com base na equação da reação química que ocorre no borbulhador, é correto afirmar que o peróxido de hidrogênio atuou no processo como agente oxidante.
Considerando que, na titulação do ácido sulfúrico formado no borbulhador, foram gastos 3,2 mol de NaOH e que o totalizador de volume indicou 4 m3 de amostra de ar, conclui-se que, nessa análise, a concentração de dióxido de enxofre no ar amostrado era de 8 × 10-4 mol / L.
O raio do íon sódio (Na+) é inferior ao do íon potássio (K+).
A equação química C2H6O + 2O2 → 2CO + 3H2O expressa corretamente a reação de combustão completa do etanol.
Considerando-se que o rendimento da reação completa de combustão do butano seja de 100%, é correto afirmar que, para a queima completa de 116 g desse hidrocarboneto, seria necessária massa mínima de oxigênio superior a 410 g.
Os átomos de um elemento Z cujo número atômico é 20 se unem com os átomos de um elemento Y cujo número atômico é 7 através de uma ligação iônica. Qual a fórmula do composto formado por esses dois elementos?
A idéia do átomo surgiu com Demócrito a cerca de 450 a.C, que dizia que a matéria era indivisível.
Essa teoria no entanto ganhou força a partir do Século XVIII com a primeira descrição de modelo atômico proposta por Dalton cuja teoria ganhou um nome, e sua descrição propunha que:
O estudo da Lei Periódica permite que sejam
estudadas as principais propriedades periódicas
dos elementos químicos.
Dados: A= massa atômica; d= densidade em
g∙cm-3
Considerando a capacidade de predição da
Tabela Periódica e dado o trecho dela, afirma-se
corretamente que a massa atômica e a
densidade mais prováveis do alumínio são,
respectivamente:
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
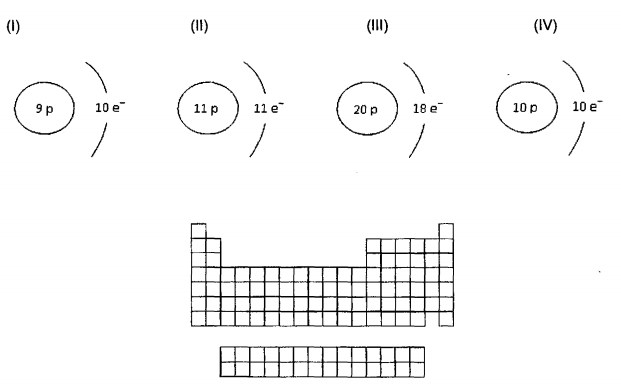
considere as espécies de (I) a (IV) e o arcabouço da Tabela Periódica representados a seguir. Assinale a alternativa correta.
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
Considere dois cilindros idênticos (Cl e C2) , de paredes rígidas e indeformáveis, inicialmente evacuados. Os cilindros Cl e C2 são preenchidos, respectivamente, com O2(g) e Ne(g) até atingirem a pressão de 0,5 atm e temperatura de 50 ºC. Supondo comportamento ideal dos gases, são feitas as seguintes afirmações:
I. O cilindro C1 contém maior quantidade de matéria que o cilindro C2 .
II. A velocidade média das moléculas no cilindro C1 é maior que no cilindro C2 .
III. A densidade do gás no cilindro C1 é maior que a densidade do gás no cilindro C2 .
IV. A distribuição de velocidades das moléculas contidas no cilindro C1 é maior que a das contidas no cilindro C2 .
Assinale a opção que apresenta a(s) afirmação(ões) CORRETA(S).
Assinale a opção que apresenta a relação ERRADA a respeito do comprimento de ligação (R) entre
pares de moléculas (neutras, cátions ou ânions), todas no estado gasoso.
Considere a energia liberada em
I. combustão completa (estequiométrica) do octano e em
II. célula de combustível de hidrogênio e oxigênio.
Assinale a opção que apresenta a razão CORRETA entre a quantidade de energia liberada por átomo de hidrogênio na combustão do octano e na célula de combustível.
Dados: Energias de ligação, em KJ mol-1:
C – C 347 H – H 436
C – H 413 H – O 464
C = O 803 O = O 498
Fonte http: / /noticias.terra.com.br/ciencia/ interna/0, , OI3818860- EI238,00.html (Texto adaptado)
Com base nas informações contidas no texto analise as seguintes proposições e classifique-as com F (falso) ou V (verdadeiro) , assinalando a opção correta.
( ) Este novo elemento químico de número atômico 112 será classificado como um elemento de transição.
( ) O elemento químico de número atômico 112 pertence ao período 7 e à coluna 12 ou 2B da classificação periódica dos elementos.
( ) Considerando ser 277 o número de massa de seu isótopo mais estável, esta espécie apresenta 165 prótons e 112 neutrons em seu núcleo.
( ) A 25°C e pressão de 1 atm, seu estado físico deverá ser gasoso.
Assinale a opção que apresenta a sequencia correta de resultados da classificação das afirmações.
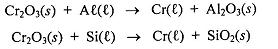
Após balancear as equações acima, assinale a alternativa correta.


