Questões Militares
Sobre transformações químicas em química
Foram encontradas 475 questões
Reação A: 2H2O + 2Na → 2NaOH + H2 Reação B: 2H2 + O2 → 2H2O
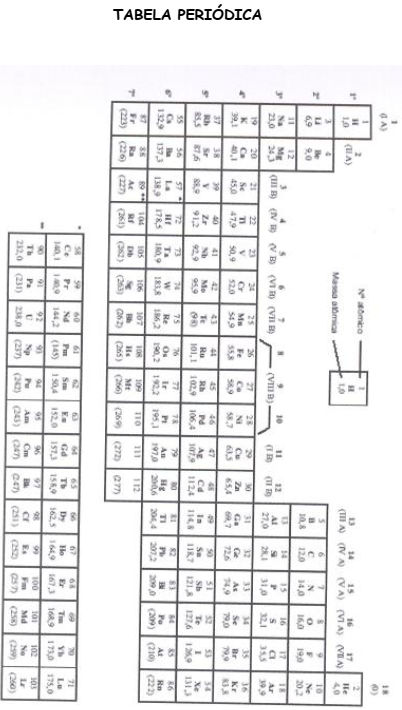
Dados: No estado fundamental o Potássio (K) possui N° Atômico = 19 e N° de Massa = 39.
Em processos industriais, a dureza elevada da água pode ser prejudicial, pois há tendência à incrustação de sais nas caldeiras, principalmente quando a água é aquecida. O aquecimento da água converte todo bicarbonato presente em carbonato pela eliminação de dióxido de carbono.
Ca(HCO3)2(aq) -> Xs + CO2(g) + H2O
A letra X representa qual sal?
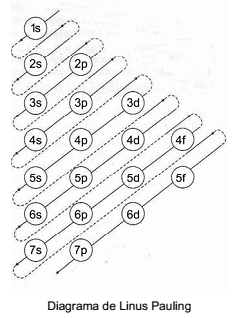
A criação de uma representação gráfica para os subníveis de
elétron facilitou a visualização da sua ordem crescente de
energia. Essa representação é conhecida como diagrama de
Linus Pauling. Com base nesse diagrama, assinale a
alternativa correta.
Os aceleradores de partículas são equipamentos que fornecem energia a feixes de partículas subatômicas eletricamente carregadas. Todos os aceleradores de partículas possibilitam a concentração de alta energia em pequeno volume e em posições arbitradas e controladas de forma precisa. Exemplos comuns de aceleradores de partículas existem nas televisões e geradores de raios-X, na produção de isótopos radioativos, na radioterapia do câncer, na radiografia de alta potência para uso industrial e na polimerização de plásticos.
(Fonte: http://www.explicatorium.com/Acelerador-particulas.php Acesso em : 26/102012)
Dentre as partículas subatômicas, aquela que apresenta carga negativa é denominada:
Observe as reações abaixo.
I - X2 + H2 → 2HX
II - 3X2 + S → SX6
III - X2 + H20 → H+ + X- + HOX
Considerando o elemento X das reações acima como um halogênio, é correto afirmar que:
Uma amostra de gás metano (CH4) foi aquecida, lentamente, na pressão constante de 0,90 bar. O volume de gás foi medido em diversas temperaturas e um gráfico de volume versus temperatura foi construído. Sabendo que o valor da inclinação da reta encontrado para o citado gráfico foi de 2,88 x 10-4 L.K-1 , qual é o valor correspondente à massa do gás metano?
Dados:
1) Considerar o gás metano como ideal; e
2) R = 8,314 x 10-2 L.bar.K-1 . mol-1
Observe as configurações eletrônicas dos átomos de C, N, Be e O abaixo representadas.
I) 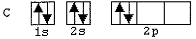
II) 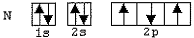
III) 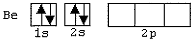
IV) 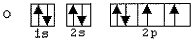
Com base nos esquemas acima, quais configurações eletrônicas
representam apenas estados excitados desses átomos?
Considere a tabela abaixo.
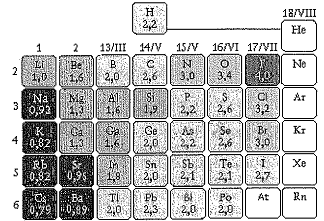
A tabela acima apresenta os valores de eletronegatividade para alguns elementos químicos dos grupos principais.
Com base nesses dados, assinale a opção que apresenta o composto
com maior caráter iônico.