Questões Militares
Sobre transformações químicas em química
Foram encontradas 475 questões
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
A concepção de átomo proposta por Rutherford permite explicar a coloração da chama emitida no processo de combustão do bário.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
A reação do potássio metálico com água forma dois produtos, um de natureza iônica e outro de natureza molecular, os quais apresentam ligações covalentes em sua estrutura.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
Considerando-se o valor aproximado de 6 × 1023 mol -1 para a constante de Avogadro, infere-se que, quando são colocados 1,8 × 1024 átomos de bário e 2 mols de gás oxigênio em reação, formam-se mais de 400 g de BaO.
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
O estado de oxidação do bário é mais reduzido na forma metálica desse elemento que na estrutura da substância que resulta como produto de sua queima.
K( s) + H2O( l) → KOH( aq) + H2(g)
Ba(s) + O2(g) → BaO(s)
Para combater a classe de incêndios gerados por esses materiais, deve-se empregar um extintor de pó químico elaborado à base de cloreto de sódio (NaCl).
Considerando o texto acima e os múltiplos aspectos que ele suscita, julgue os itens a seguir, utilizando, caso necessário, a tabela periódica inserida no final deste caderno de provas.
No material base que compõe o pó químico dos extintores utilizados contra incêndios classe D, a espécie química cloro apresenta a configuração eletrônica 1s 2 2s 2 2p6 3s 2 3p5 , conforme o diagrama de Linus Pauling.
Com relação aos metais Pb, Ba e Sb: I – O raio atômico do Pb é maior que o do Ba e Sb. II – O Ba é mais eletronegativo que o Pb e menos que o Sb. III – O potencial de ionização aumenta na sequência Ba, Pb e Sb. IV – O Pb é mais denso que o Sb e o Ba.
A afirmativa correta é:
Certo composto β é produzido através da reação:
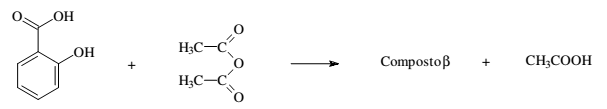
Dois bécheres são colocados em um sistema fechado, mantido a 40 °C. O bécher da esquerda contém 200 mL de etanol, enquanto o da direita contém uma solução de 500 mg do composto β em 200 mL de etanol, conforme a representação a seguir.
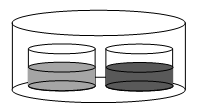
Assinale a alternativa que melhor representa os níveis de líquido nos bécheres três horas após o início do
confinamento.
Um experimento clássico indica que o oxigênio molecular (O2) exibe propriedades magnéticas no seu estado fundamental. O experimento consiste em fazer passar oxigênio líquido pelos polos de um ímã. Observa-se que o oxigênio fica retido, como mostra a figura a seguir:
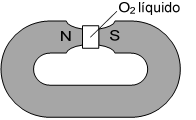
Nas alternativas abaixo, são apresentados os orbitais 2p de dois átomos de oxigênio e o spin dos elétrons que ocupam seus orbitais atômicos. Também são apresentadas possíveis interações químicas que podem resultar em ligações químicas estabelecidas entre esses dois átomos.
Considerando a observação experimental e os requisitos eletrônicos e energéticos para o
estabelecimento de ligações químicas, indique qual das alternativas abaixo representa melhor o O2 no
estado fundamental.
Em 19,9 g de um sal de cálcio encontra-se 0,15 mol desse elemento. Qual a massa molar do ânion trivalente que forma esse sal?
Dado: Ca = 40 g/mol.

Dados: M(g/mol): C = 12, S = 32; O = 16, N = 14, K = 39
Para formular uma mistura baseada na estequiometria da reação, a proporção em massa dos constituintes enxofre, carvão vegetal e salitre na mistura deve ser, respectivamente:
No modelo atômico de Bohr:
1. O elétron circula em órbita com raio definido.
2. O elétron é descrito por uma função de onda.
3. Para descrever o elétron num orbital são necessários 4 números quânticos.
4. Toda a massa do átomo está concentrada no núcleo, que ocupa uma porção ínfima do espaço.
Entre as afirmativas acima, correspondem ao modelo atômico de Bohr:
Os exemplos descritos a seguir correspondem às observações realizadas para uma quantidade fixa de matéria de gás e variação de dois parâmetros. Numere as representações gráficas relacionando-as com as seguintes descrições.
1. Ao encher um balão com gás hélio ou oxigênio, o balão apresentará a mesma dimensão.
2. Ao encher um pneu de bicicleta, é necessária uma pressão maior que a utilizada em pneu de carro.
3. O cozimento de alimentos é mais rápido em maiores pressões.
4. Uma bola de basquete cheia no verão provavelmente terá aparência de mais vazia no inverno, mesmo que não tenha vazado ar.
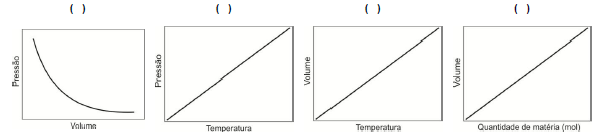
Assinale a alternativa que apresenta a sequência correta na numeração das representações gráficas.
A notícia publicada neste ano trata de um projeto de mineração de potássio. Sobre esse elemento, analise as afirmativas a seguir:
1. É um metal.
2. Soluções salinas de seus haletos costumam ser levemente alcalinas.
3. Na mineração, é extraído como substância simples de águas de lagos e rios.
4. Sua principal aplicação é em fertilizantes, onde é o terceiro macronutriente da sigla NPK.
Assinale a alternativa correta.
Considere um mol de um gás que se comporta idealmente, contido em um cilindro indeformável provido de pistão de massa desprezível, que se move sem atrito. Com relação a este sistema, são feitas as seguintes afirmações:
I. Se o gás for resfriado contra pressão externa constante, o sistema contrai-se.
II. Se pressão for exercida sobre o pistão, a velocidade média das moléculas do gás aumenta.
III. Se o sistema for aquecido a volume constante, a velocidade média das moléculas aumenta, independentemente da natureza do gás.
IV. A velocidade média das moléculas será maior se o gás for o xenônio e menor se for o argônio.
Das afirmações acima, está(ão) ERRADA(S) apenas