Questões de Concurso
Sobre farmacotécnica e tecnologia farmacêutica em farmácia
Foram encontradas 2.280 questões
Analise as afirmativas a seguir relativas à validação de métodos bionalíticos, considerando o previsto em tal Resolução.
I. Os métodos cromatográficos são considerados os de primeira escolha para moléculas passíveis de serem analisadas por essa técnica.
II. A utilização de padrão ou substância química de referência farmacopeica isenta a utilização de padrão interno nas análises.
III. A validação deve conter ensaios de precisão, exatidão, curva de calibração, efeito residual, efeito matriz, seletividade e estabilidade, conforme as especificações de cada ensaio.
IV. O método bioanalítico implementado pode ser utilizado para análise de amostras reais, desde que já tenha passado por, pelo menos, uma validação parcial constituída pelas análises dos ensaios de precisão, exatidão e linearidade com a curva de calibração.
Estão corretas as afirmativas
Em relação às estratégias farmacotécnicas empregadas para minimizar os efeitos dos fatores que afetam a sedimentação e movimentação das partículas sólidas numa suspensão, é incorreto afirmar que
Em relação aos princípios biofarmacêuticos da liberação de fármacos a partir de formas farmacêuticas sólidas, é correto afirmar que
Em relação aos fatores que afetam o processo de absorção de fármacos através do trato gastrintestinal, é incorreto afirmar que
I. A clorpropamida é uma sulfonilureia de primeira geração.
II. A metformina é uma meglitinida que age reduzindo a produção hepática de glicose.
III. A glibenclamida é uma sulfonilureia de segunda geração.
IV. A nateglinida é um fármaco tipo biguanida.
Estão CORRETOS:
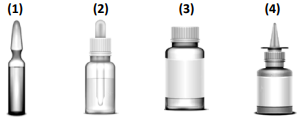
Qual das seguintes embalagens de medicamentos é uma ampola?
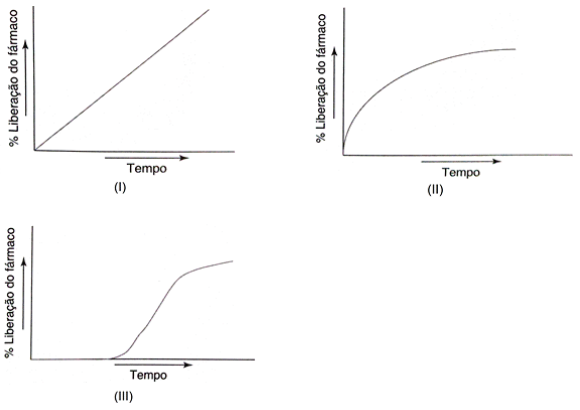
Fonte: Aulton, M. E. e Taylor, L. M. G. Aulton - Delineamento de formas farmacêuticas. 4 ed. – Rio de Janeiro: Elsevier, Capítulo 31 – Formas farmacêuticas de liberação controlada para uso oral. 2016. (Adaptado)
As Figuras I, II e III apresentam o perfil de liberação de IFA, a partir de uma forma farmacêutica. Qual(is) destes perfis corresponde(m) a um perfil de liberação retardada?
Forma Farmacêutica Semissólida
1. Pomada
2. Gel
3. Unguento
4. Cerato
5. Linimento
Conceito
( ) Forma farmacêutica de consistência firme e macia, caracterizada pela elevada proporção de substâncias de origem animais e/ou vegetais, de mistura com óleos, podendo conter ou não essências, e destinada ao uso externo.
( ) Forma farmacêutica contendo IFA dissolvidos em óleos ou solventes adequados, emulsionados ou suspensos, em misturas ou não com sabões, destinados à aplicação sobre a pele, por meio de massagens ou fricções.
( ) Forma farmacêutica caracterizada por ser uma dispersão coloidal, composta por macromoléculas, que se apresenta estável fisicamente, com elevado teor de água, portanto, é lavável e bastante adequada para formulações de uso tópico.
( ) Forma farmacêutica de consistência macia, viscosidade elevada, pegajosa, destinada à aplicação externa na pele ou mucosas, que contenham um ou mais IFA incorporados em excipientes adequados.
( ) Forma farmacêutica de consistência firme, porém, macia, destinada ao uso externo e caracterizada pela presença de substâncias resinosas.
A sequência CORRETA é:
Fonte: Storpirtis, S.; Gonçalves, J. E., Chiann, C.; Gai, M. N. Biofarmacotécnica. Rio de Janeiro: Guanabara Koogan, Capítulo 2 – Insumos Farmacêuticos – Aspectos Técnicos, Científicos e Regulatórios. 2009. (Adaptado)
Sobre a absorção dos IFA, analise as afirmações abaixo:
I- A solubilidade de um IFA ácido fraco é maior, quando o pH do meio apresenta um valor acima do seu pKa.
II- A absorção de um IFA básico fraco é maior, quando o pH do meio apresenta um valor abaixo do seu pKa.
III- A velocidade de absorção intestinal de um IFA ácido fraco é, muitas vezes, maior do que a velocidade, com que esse IFA é absorvido no estômago, ainda quando ele está ionizado no intestino.
IV- Mudança do pH do IFA, por alterações ocorridas na formulação, não altera a sua biodisponibilidade.
É CORRETO o que se afirma apenas em:
Incompatibilidades farmacotécnicas equivalem aos efeitos recíprocos entre dois ou mais componentes de uma preparação farmacêutica, com propriedades diferentes entre si que frustram ou colocam em dúvida a finalidade para qual foi concebido o medicamento.
Sobre os tipos de incompatibilidades farmacotécnicas, analise as afirmações abaixo:
I- Liquefação de ingrediente sólido é uma incompatibilidade química que ocorre quando se mistura compostos sólidos e estes se liquefazem através da formação de misturas eutéticas ou da liberação de água por hidratação.
II- Precipitação é uma incompatibilidade física que ocorre, geralmente, quando uma substância precipita, ao se adicionar à solução outro solvente, no qual ela seja insolúvel.
III- Hidrólise é uma incompatibilidade química, na qual o fármaco interage com oxigênio, produzindo compostos químicos de natureza variável.
IV- Reação de Maillard é uma incompatibilidade química, na qual ocorre uma reação não-enzimática de escurecimento que acontece entre um açúcar e um grupamento amino.
É CORRETO o que se afirma apenas em:
Qual alternativa se refere ao CORRETO enquadramento da Regra dos Cinco de Lipinski?
O enunciado descreve corretamente a:
Considerando os conceitos e o preparo de emulsões, assinale a afirmativa incorreta.
I- Forma farmacêutica: representa todas as técnicas executadas com o objetivo de transformar um fármaco (ativo) em uma forma farmacêutica ou cosmética.
II- Operações farmacotécnicas: representam o estado final de apresentação dos produtos, ou seja, a transformação dos princípios ativos farmacêuticos por meio de uma ou mais operações farmacêuticas executadas com ou sem a adição de excipientes/veículo, a fim de permitir a sua utilização e obter o efeito terapêutico desejado.
III- Preparação: procedimento farmacotécnico aplicado para a obtenção do produto manipulado, compreendendo as etapas de avaliação farmacêutica da prescrição, manipulação, fracionamento de substâncias ou produtos industrializados, envase, rotulagem e conservação do que foi manipulado.
IV- Preparação magistral: produto preparado/manipulado, cuja fórmula esteja inscrita no Formulário Nacional ou em Formulários Internacionais reconhecidos pela Anvisa, ou seja, o produto deve seguir a fórmula como descrita nos compêndios reconhecidos como oficiais.