Questões de Concurso
Sobre cinética química em química
Foram encontradas 645 questões
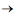 CH4
(g) + 2 H2O(l)
CH4
(g) + 2 H2O(l) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
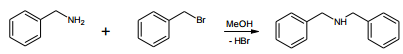 Em um experimento conduzido a 298 K, com excesso de
benzilamina, o perfil de decaimento do brometo de benzila foi
registrado, sendo apresentado na figura a seguir.
Em um experimento conduzido a 298 K, com excesso de
benzilamina, o perfil de decaimento do brometo de benzila foi
registrado, sendo apresentado na figura a seguir.
Nessas condições, o tempo (em minutos) em que a concentração de brometo de benzila terá sido reduzida à 1/8 da concentração inicial é de
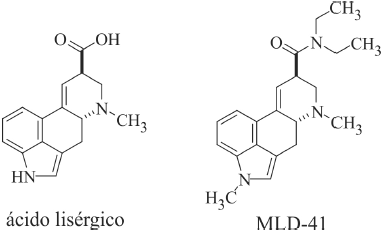
O ácido lisérgico é um alcaloide a partir do qual se originaram
lisergamidas como a MLD-41, substância com propriedades
psicodélicas. Considerando as estruturas químicas mostradas nas
figuras precedentes, bem como as propriedades físicas e químicas
dos grupos funcionais presentes em suas moléculas, assinale
a opção correta.
Texto 5A3CCC
Considere que, na temperatura T0, a constante de equilíbrio para a reação de decomposição do N2O4 (g) apresentada a seguir seja igual a 4,0 e que o comportamento dos gases envolvidos nessa reação seja ideal. N2O4 (g) + calor » 2NO2 (g)
De acordo com as informações do texto 5A3CCC, se, em determinado instante, na temperatura T0, as pressões parciais de N2O4 (g) e NO2 (g) dentro de uma câmara forem iguais a 0,16 bar e 0,80 bar, respectivamente, então
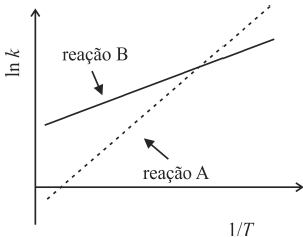
A partir da equação de Arrhenius e do gráfico precedente,
correspondente ao logaritmo neperiano da constante de velocidade
(k) em função do inverso da temperatura (T), em graus kelvin, para
as reações A e B, é correto afirmar que a reação A apresenta
energia de ativação
Texto 5A3AAA
experimento |
concentração inicial (mol.L–1) /S2O82- I- |
velocidade inicial (mol.L-1 .s-1) |
|
1 |
0,15 |
0,20 |
1,1 |
2 |
0,30 |
0,20 |
2,2 |
3 |
0,30 |
0,10 |
1,1 |
A tabela acima apresenta a velocidade inicial da reação seguinte em função das concentrações iniciais dos reagentes. S2O8 2- (aq) + 3 I- (aq) -> 2 SO42- (aq) + I3- (aq)
Texto 5A3AAA
experimento |
concentração inicial (mol.L–1) /S2O82- I- |
velocidade inicial (mol.L-1 .s-1) |
|
1 |
0,15 |
0,20 |
1,1 |
2 |
0,30 |
0,20 |
2,2 |
3 |
0,30 |
0,10 |
1,1 |
A tabela acima apresenta a velocidade inicial da reação seguinte em função das concentrações iniciais dos reagentes. S2O8 2- (aq) + 3 I- (aq) -> 2 SO42- (aq) + I3- (aq)
Al(s) + I2(s) → AlI3(s)
Com base nessas informações, partindo-se de 1,40 moles de Al e 3,00 moles de I₂, o reagente limitante e o rendimento teórico do produto serão respectivamente:
• dobrando a concentração de A, a velocidade de formação de C duplica; e
• dobrando a concentração de B, a velocidade de reação de C quadruplica.
Com base nessas informações,
Uma reação de grande importância do propeno é a hidroformilação: o propeno reage com o chamado gás de síntese — uma mistura de CO(g) e H2(g) — para gerar aldeídos, conforme mostra o esquema seguinte.

O interesse industrial pelas reações de hidroformilação advém do fato de os aldeídos resultantes dessas reações serem compostos muito versáteis, usados como matéria-prima para a preparação de diversos outros compostos. Por exemplo, o butanal pode ser usado na síntese do composto 1, conforme indicado no esquema a seguir.

Além disso, a depender das condições reacionais e do catalisador empregado, reações consecutivas podem suceder a hidroformilação, produzindo diretamente outros compostos, conforme exemplificado no seguinte esquema.

A respeito dos compostos e das reações apresentados, julgue o próximo item.
O H2 é um gás inodoro, explosivo, que pode ser produzido a
partir da reforma catalítica do metano ou da hidrólise da água.
[A] (M) [B] (M) velocidade inicial (m/s)
2,16 0,525 8,05 × 10-3
2,16 1,05 3,22 × 10-2
4,33 0,525 4,03 × 10-3
velocidade = k · [A]m · [B]n
Considerando a reação química geral aA + bB → produtos e as velocidades iniciais, as molaridades e a lei de velocidade mostradas na tabela acima, julgue o item subsequente.
O valor de k é maior que 5,5 × 10-2 s-1.
[A] (M) [B] (M) velocidade inicial (m/s)
2,16 0,525 8,05 × 10-3
2,16 1,05 3,22 × 10-2
4,33 0,525 4,03 × 10-3
velocidade = k · [A]m · [B]n
Considerando a reação química geral aA + bB → produtos e as velocidades iniciais, as molaridades e a lei de velocidade mostradas na tabela acima, julgue o item subsequente.
Os valores de m e n são 2 e -1, respectivamente.
[A] (M) [B] (M) velocidade inicial (m/s)
2,16 0,525 8,05 × 10-3
2,16 1,05 3,22 × 10-2
4,33 0,525 4,03 × 10-3
velocidade = k · [A]m · [B]n
Considerando a reação química geral aA + bB → produtos e as velocidades iniciais, as molaridades e a lei de velocidade mostradas na tabela acima, julgue o item subsequente.
Para a reação de segunda ordem aA + bB → produtos umgráfico de ln [A] versus o tempo é representado por uma reta.
Um dos objetivos principais da cinética química é a determinação das leis da velocidade, isto é, expressões matemáticas simples que informam com que rapidez uma reação química ocorre. Leis de velocidade com formas matemáticas semelhantes pressupõem que as reações que elas representam se comportam de uma mesma maneira, à medida que a reação ocorre. Com relação a esse assunto,julgue o próximo item.
A velocidade de uma reação química indica quantos mols de um reagente estão reagindo ou quantos mols de um produto estão sendo formados durante certo período.
Um dos objetivos principais da cinética química é a determinação das leis da velocidade, isto é, expressões matemáticas simples que informam com que rapidez uma reação química ocorre. Leis de velocidade com formas matemáticas semelhantes pressupõem que as reações que elas representam se comportam de uma mesma maneira, à medida que a reação ocorre. Com relação a esse assunto,julgue o próximo item.
Se a reação química — H2 + O2 → H2O — ocorre a uma velocidade igual a -6 mol/min em relação a H2, é correto afirmar que a velocidade em relação a O2 é igual a -3 mol/min.
O biodísel pode ser obtido a partir da reação de transesterificação do óleo de soja catalisada por base. Com o objetivo de aumentar o rendimento do produto dessa reação em bancada, foi aplicada a metodologia de planejamento fatorial, sendo os fatores, níveis estudados e efeitos obtidos apresentados na tabela abaixo.

Considerando as informações acima apresentadas, julgue o item a seguir, relativos à otimização da reação e ao planejamento de experimentos realizados.
Para aumentar o rendimento da reação em apreço deve-se usar
KOH e realizá-la à temperatura de 50 °C durante o tempo
de 60 min.