Questões de Concurso
Sobre cinética química em química
Foram encontradas 645 questões
Experimentalmente constata-se que a(o)
NaNO3(s) + H2 SO 4(aq) → NaHSO4(aq)+ HNO3(aq)
Cinética Química é o estudo da velocidade das reações e dos fatores que a influenciam. Assim sendo, observando as condições especificadas para o salitre do Chile e para o ácido sulfúrico, respectivamente, a opção em que a ve- locidade da reação é mais rápida corresponde a
NH4NO3 ? 2N2 + 4H2O + O2
O nitrato de amônio é produzido pela simples neutralização do ácido nítrico, pelo amoníaco segundo a reação:
NH3(g) + HNO3(aq) ? NH4NO3(aq)
Em um estudo sobre a cinética dessa reação foram obtidos os seguintes dados:
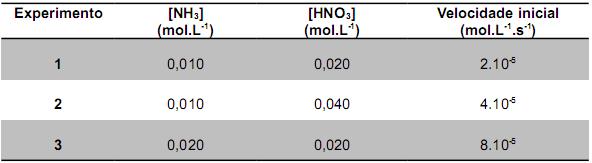
Como base nesses dados cinéticos e na estequiometria da reação, assinale a alternativa CORRETA.
CH4( g) + CO2( g) + calor ⇌ 2CO(g) + 2H2(g) (reação I)
CO(g ) + 2H2(g ) ⇌ CH3OH(g) + calor (reação II)
Na figura abaixo, são apresentadas as curvas do coeficiente de compressibilidade (Z) do metano em duas temperaturas diferentes: 20 ºC e T2.

Para a reação II, o emprego de pressões elevadas favorece a formação dos produtos tanto do ponto de vista do equilíbrio químico, quanto da cinética. Entretanto, o emprego de temperaturas elevadas favorece a formação dos produtos do ponto de vista da cinética, mas desfavorece do ponto de vista do equilíbrio
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

Considerando-se condições em que o tempo de meia-vida da água oxigenada seja igual a 2 anos, é correto afirmar que em um período de 8 anos haverá a decomposição de mais de 90% da quantidade inicial de água oxigenada contida em uma solução.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

De acordo com o gráfico apresentado, a reação em questão é uma reação de primeira ordem em relação à concentração da água oxigenada.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

O cloreto férrico aumenta a energia de ativação da reação, de forma que maior fração das moléculas de água oxigenada terá energia suficiente para ativar a reação.
Na nitração mostrada na reação acima, são adicionados 5 moles de benzeno e 6 moles de ácido nítrico.
Após 1 hora de reação, obtém-se uma conversão de 60%.
O número de moles de reagente limitante que resta na reação e a massa, em gramas, formada de produto são, respectivamente,
Dados:
Massa Atômica do Carbono = 12
Massa Atômica do Oxigênio = 16
Massa Atômica do Nitrogênio = 14
Massa Atômica do Hidrogênio = 1
Nesse processo, normalmente, o agente limitante e o reagente em excesso são, respectivamente,
Al2 O3 + 2 NaOH → 2 NaAlO2 + H2O
Se a bauxita a ser tratada tem 50% (m/m) de óxido de alumínio e a quantidade a ser tratada é 1.020 toneladas, quantas toneladas de solução de soda cáustica devem ser utilizadas?
Dados:
Massa Atômica do Alumínio = 27
Massa Atômica do Sódio = 23
Massa Atômica do Hidrogênio = 1
Massa Atômica do Oxigênio = 16
Densidade da Água = 1,0 kg/L
No entanto, se, em uma certa temperatura constante, esse processo alcança uma situação de equilíbrio, e o valor de constante de equilíbrio, “K”, é igual a 1, a quantidade de reagente no equilíbrio é
 , à temperatura ambiente, foi determinada experimentalmente por um técnico em química, e os dados encontrados estão sumarizados na tabela.
, à temperatura ambiente, foi determinada experimentalmente por um técnico em química, e os dados encontrados estão sumarizados na tabela.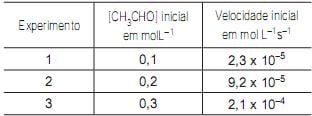
A constante de velocidade de decomposição do etanal é:
2A(g)+ 3B(g) → A2 B 3(g)
De um conjunto de experimentos foram coletados dados e estes, organizados na seguinte tabela:

Nesse sentido, observa-se que
A decomposição do ozônio é representada pela seguinte equação não balanceada: O3 → O2, e a lei da velocidade dessa reação é representada pela seguinte equação: e a lei da velocidade dessa reação é representada pela seguinte equação: V = k [ O3]2 [ O2]-1.
Considerando essa situação hipotética e sabendo que, durante o processo de compostagem, as proteínas presentes na matéria orgânica do lixo são hidrolisadas por enzimas proteolíticas produzidas por microrganismos, gerando polipeptídios, aminoácidos e outros derivados nitrogenados, e o nitrogênio orgânico é convertido à forma amoniacal, julgue os próximos itens.
Durante o processo de compostagem, ocorrem fenômenos químicos envolvendo processo de catálise, no qual moléculas maiores são convertidas em moléculas menores.
Fe3O4(s)+ 4 H2(g)↔ 3 Fe(s)+ 4 H2(g) ΔH = -209,5 kcal.mol -1
e considerando as afirmações seguintes,
I. A adição de um catalisador desloca o equilíbrio para direita.
II. O aumento da pressão desloca o equilíbrio para a esquerda.
III. A diminuição da temperatura desloca o equilíbrio para a direita.
IV. A diminuição da pressão desloca o equilíbrio para a direita.
V. O aumento da temperatura desloca o equilíbrio para a esquerda.
verifica-se que está(ão) correta(s)
 3C(g) a 523 K, contido em um recipiente de 2 L, h 1, 2 e 4 mols dos gases A, B e C, respectivamente, no equilíbrio. Nessa situação, considerando R = 0,08 atm × L × mol -1 × K-1 e que todos os gases são ideais, os valores de KC e Kp são, respectivamente, iguais a
3C(g) a 523 K, contido em um recipiente de 2 L, h 1, 2 e 4 mols dos gases A, B e C, respectivamente, no equilíbrio. Nessa situação, considerando R = 0,08 atm × L × mol -1 × K-1 e que todos os gases são ideais, os valores de KC e Kp são, respectivamente, iguais a C2H5SH + H2 → C2H6 + H2S
O H2S é posteriormente convertido em H2SO4. O enxofreou o ácido sulfúrico produzidos na dessulfurização do petróleosão importantes matérias-primas para outras indústrias, como a deplásticos e a farmacêutica.
Tendo as informações acima como referência inicial, julgue os itens a seguir.
A reforma catalítica mencionada no texto é equivalente ao processo conhecido como craqueamento ou pirólise.