Questões de Concurso
Sobre cinética química em química
Foram encontradas 829 questões
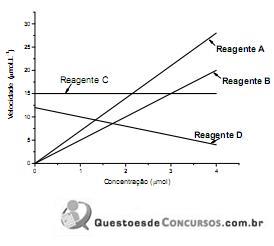
Tendo em vista os resultados do gráfico acima, é incorreto afirmar que o(a)
Quanto à evolução inicial de gás nos copos, como a reação não tem cinética de ordem zero, observa-se
i) A velocidade inicial de uma reação cuja cinética é de primeira ordem depende apenas de um dos reagentes envolvidos no processo reacional.
ii) O tempo de meia-vida de uma reação é aquele intervalo de tempo em que a concentração de um dos reagentes diminui pela metade.
iii) Numa reação com cinética de primeira ordem, todos os tempos de meia-vida do processo têm valores iguais
Com base nessas informações, numa reação de cinética de primeira ordem, um reagente, cuja concentração inicial é 0,60 mol/L, e cujo tempo de meia-vida é igual a 1 min, atinge a concentração de 7,5 x 10-2 mol/L em
Experimentalmente constata-se que a(o)
NaNO3(s) + H2 SO 4(aq) → NaHSO4(aq)+ HNO3(aq)
Cinética Química é o estudo da velocidade das reações e dos fatores que a influenciam. Assim sendo, observando as condições especificadas para o salitre do Chile e para o ácido sulfúrico, respectivamente, a opção em que a ve- locidade da reação é mais rápida corresponde a
NH4NO3 ? 2N2 + 4H2O + O2
O nitrato de amônio é produzido pela simples neutralização do ácido nítrico, pelo amoníaco segundo a reação:
NH3(g) + HNO3(aq) ? NH4NO3(aq)
Em um estudo sobre a cinética dessa reação foram obtidos os seguintes dados:
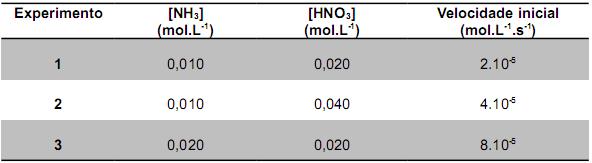
Como base nesses dados cinéticos e na estequiometria da reação, assinale a alternativa CORRETA.
CH4( g) + CO2( g) + calor ⇌ 2CO(g) + 2H2(g) (reação I)
CO(g ) + 2H2(g ) ⇌ CH3OH(g) + calor (reação II)
Na figura abaixo, são apresentadas as curvas do coeficiente de compressibilidade (Z) do metano em duas temperaturas diferentes: 20 ºC e T2.

Para a reação II, o emprego de pressões elevadas favorece a formação dos produtos tanto do ponto de vista do equilíbrio químico, quanto da cinética. Entretanto, o emprego de temperaturas elevadas favorece a formação dos produtos do ponto de vista da cinética, mas desfavorece do ponto de vista do equilíbrio
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

Considerando-se condições em que o tempo de meia-vida da água oxigenada seja igual a 2 anos, é correto afirmar que em um período de 8 anos haverá a decomposição de mais de 90% da quantidade inicial de água oxigenada contida em uma solução.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

De acordo com o gráfico apresentado, a reação em questão é uma reação de primeira ordem em relação à concentração da água oxigenada.
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

O cloreto férrico aumenta a energia de ativação da reação, de forma que maior fração das moléculas de água oxigenada terá energia suficiente para ativar a reação.
Nas reações orgânicas pode ocorrer a formação de grupos intermediários instáveis nos quais o átomo de carbono não apresenta quatro ligações. Esses grupos se originam da ruptura de ligações entre átomos, que pode ocorrer de forma homogênea ou heterogênea. Denomina-se ruptura ______________ quando a ligação entre átomos com ______________ eletronegatividade se rompe e origina ______________ .
As lacunas do texto são preenchidas, correta e respectivamente, por:Foram preparadas separadamente, usando água purificada por destilação e por troca iônica (pH =7), soluções 1,0 mol . L– 1 de
Acetato de sódio;
Oxalato de potássio;
Carbonato de sódio;
Nitrato de amônio;
Cloreto de alumínio.
Medindo-se seus valores de pH a 25 ºC, verifica-se corretamente que apresentam valores de pH < 7 as soluções de
Um gás produzido em uma reação foi caracterizado pela medida de sua densidade a 300 K e 1,00 atm, cujo valor aproximado é 2,90 g.L– 1. É correto afirmar que esse gás é o
Dado: R = 8,20 x 10– 2 atm.L.mol– 1.K– 1A equação do gás ideal é uma aproximação adequada para diversas situações em cálculos com espécies gasosas. Porém, o comportamento dos gases reais desvia da idealidade e esse desvio cresce em _____________ temperaturas _____________ e pressões. Em pressões _____________ esse desvio se justifica, pois prevalecem as forças intermoleculares _____________ .
As lacunas do texto são preenchidas, correta e respectivamente, porO ácido acético — substância que confere o sabor azedo ao vinagre — pode ser quantificado utilizando-se uma titulação de neutralização com o hidróxido de sódio como agente titulante. Considerando essas informações e os múltiplos aspectos relacionados a elas, julgue os itens a seguir.
Na titulação de 25 mL de NaOH a 0,10 mol/L utilizando-se 25,5 mL de HCl a 0,10 mol/L, gera-se uma solução de pH próximo do valor neutro.
O ácido acético — substância que confere o sabor azedo ao vinagre — pode ser quantificado utilizando-se uma titulação de neutralização com o hidróxido de sódio como agente titulante. Considerando essas informações e os múltiplos aspectos relacionados a elas, julgue os itens a seguir.
Um indicador ácido/base é qualquer substância orgânica passível de mudança de cor em diferentes valores de pH.
O ácido acético — substância que confere o sabor azedo ao vinagre — pode ser quantificado utilizando-se uma titulação de neutralização com o hidróxido de sódio como agente titulante. Considerando essas informações e os múltiplos aspectos relacionados a elas, julgue os itens a seguir.
A utilização de solventes não aquosos, como o álcool etílico, é necessária nas titulações de ácidos ou bases muito fracas.
O ácido acético — substância que confere o sabor azedo ao vinagre — pode ser quantificado utilizando-se uma titulação de neutralização com o hidróxido de sódio como agente titulante. Considerando essas informações e os múltiplos aspectos relacionados a elas, julgue os itens a seguir.
Na titulação, a quantidade de reagente padronizado necessária para atingir a equivalência química relaciona-se com a quantidade de analito presente.