Questões de Concurso
Sobre cinética química em química
Foram encontradas 645 questões
De acordo com os dados da tabela abaixo de velocidade para a reação dos íons amônio e nitrito em água a 25ºC:
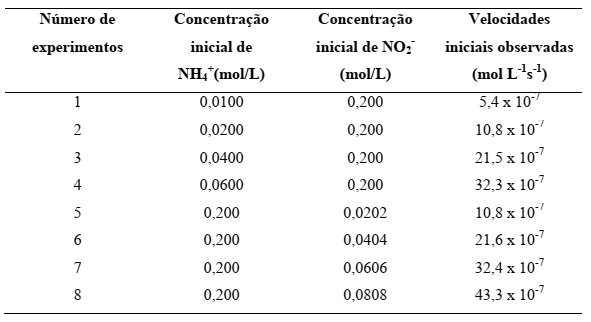
Podemos afirmar que a velocidade para [NH4
+
] = 0,100 mol/L e [NO2
-
] = 0,100 mol/L em mol
L
-1
s
-1
é:
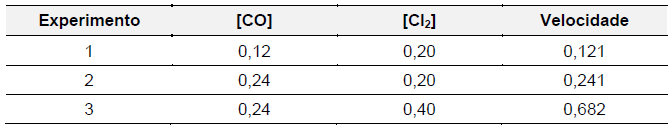
Na seguinte tabela, são apresentados os dados referentes a três experimentos de combustão do monóxido de carbono, conduzidos à temperatura de 300 K, em atmosfera padrão.
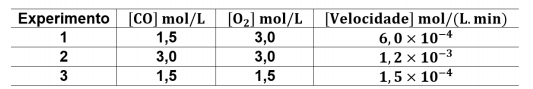
Com base nesses experimentos, a ordem global da reação é igual a
Uma reação do tipo 2A(g) + Z(g) →2T(g) foi monitorada variando-se a concentração dos reagentes. A velocidade de formação de T foi medida conforme a tabela abaixo.
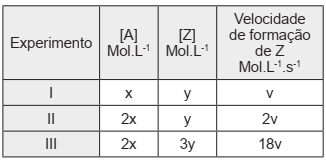
Determine a lei de velocidade e calcule a velocidade da reação em função de v se [A] for x e [Z]
for 3y.
Considere a reação hipotética X + Y ⇌ W, cuja velocidade de reação (v) foi determinada a partir das concentrações iniciais de X e Y, segundo os experimentos apresentados na tabela a seguir.
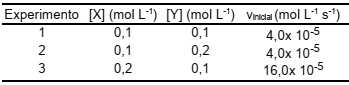
Baseando-se nos resultados apresentados na tabela, a
constante de velocidade de reação (k), em mol L-1 s-1
, é,
aproximadamente, igual a
Considerando:
I) Os dados da questão anterior, II) Que o decaimento radioativo é um processo cinético de primeira ordem que atende à equação: ln N – ln N0 = λ. t III) ln 2 = 0,693.
A constante de decaimento, em ano-1 , para o césio 137 nesse caso seria igual a:
Considerando I) os dados da questão anterior, II) que o decaimento radioativo é um processo cinético de primeira ordem que atende à equação ln N – ln N0 = λ. t e III) que ln 2 = 0,693,
a constante de decaimento, em ano-1 , para o césio 137, nesse caso, seria igual a
Dados: [A]0 = concentração inicial; k= constante de velocidade e t = tempo
O monóxido de nitrogênio, quando liberados pelos automóveis na baixa atmosfera, rapidamente se transforma em dióxido de nitrogênio, que em seguida, irá colaborar na formação do ozônio troposférico, um poluente. Um estudo dessa reação no laboratório revelou que, para que ela se tornasse quatro vezes mais rápida, poderia ser feita a seguinte alteração: manter fixa a concentração de O2 e duplicar a de NO.
Considerando o enunciado acima, atente para as seguintes afirmações:
I. A lei da velocidade dessa reação pode ser dada por: v = k[NO]2 [O2].
II. Essa deve ser uma reação elementar, ou seja,
realizada em apenas uma etapa.
Sobre essas afirmações, é correto diz que
Dado que log 2,8 = 0,45 e log 2 = 0,3, o valor da constante da velocidade desta reação é
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
A reação de decomposição do H2O2 libera maior quantidade de calor quando é realizada à pressão constante de 1 bar do que quando é realizada a volume constante.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
O fato de a reação de decomposição do H2O2 ser de primeira
ordem implica tratar-se de uma reação elementar.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
O tempo necessário para que a concentração de H2O2 caia a
10% do valor inicial equivale a 10 × ek
, em que k é a constante
de velocidade da reação de decomposição do H2O2.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
A curva resultante da plotagem do logaritmo neperiano da
concentração do H2O2 em função do tempo de reação resulta
em uma reta com inclinação negativa.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


A partir do gráfico apresentado e de acordo com a equação de Arrhenius, é possível determinar que a energia de ativação da reação é superior a 1,0 × 105 J × mol-1 .


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A quantidade de calor liberada por mol de moléculas de H2O2
decompostas é maior na reação realizada em presença do
catalisador do que na reação não catalisada.