Questões de Concurso
Sobre cinética química em química
Foram encontradas 829 questões
Nitrogênio e Oxigênio são os gases mais abundantes da nossa atmosfera. Em temperaturas ambientes, eles reagem muito pouco, mas, nos motores dos automóveis, trabalhando em temperaturas que podem chegar a cerca de 700⁰C, a reação começa a ser favorável, tornando necessária a presença de catalisadores nos veículos como uma forma de controle da poluição atmosférica.
Observe os dados a seguir:
O valor do Kp para esta reação a 900K é de
A água é uma substância tradicionalmente usada no combate a incêndios por diversas razões. Analise as afirmações a seguir.
I. Ela dificulta o contato entre o combustível e o Oxigênio.
II. Parte da energia liberada na combustão é usada para vaporizar a água, tornando-a indisponível para a combustão.
III. Estando a água em temperatura mais baixa, ela contribui para a diminuição da velocidade global da reação de combustão em andamento.
IV. Água pressurizada empurra o ar para longe do material em combustão.
Assinale a opção que apresenta afirmativas que envolvem fatores cinéticos que explicam a eficiência da água no combate aos incêndios.
Considere o gráfico a seguir.
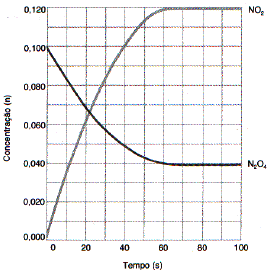
Disponível em: <http://www.ensinoadistancia.pro.br/ead/qg/aula-17/aula-17.html>. Acesso em: 2 out. 2016.
Por meio da análise do gráfico de equilíbrio químico da reação de decomposição do N2O4, foi
construída uma tabela de evolução temporal do processo reativo. A alternativa que expressa essa
tabela corretamente é:
Considere o gráfico a seguir.
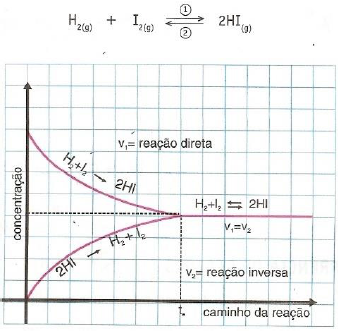
Disponível em: <https://www.bing.com/images>. Acesso em: 2 out. 2016.
Por meio da análise do gráfico, é possível destacar que o equilíbrio
Considere o gráfico a seguir.
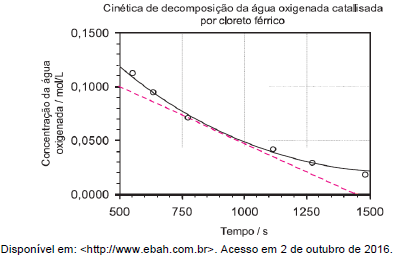
O gráfico expressa a cinética de decomposição da água oxigenada catalisada por
cloreto férrico. Por meio desse gráfico, verifica-se que a
A hidrólise de sais de alguns metais pode levar à formação de acidez mineral nas águas, como ocorre nas estações de tratamento de águas para abastecimento público, por exemplo, com cloreto de ferro (III) ou sulfato de alumínio, conforme indicado nas equações químicas (I) e (II) abaixo.
(I) Al2(SO4)
3(aq) + 6H2O  2Al(OH)3(s) + 6H+
(aq) + 3SO42- (aq)
2Al(OH)3(s) + 6H+
(aq) + 3SO42- (aq)
(II) FeCl3(aq) + 3H2O  Fe(OH)3(s) + 3H+
(aq) + 3Cl−
(aq)
Fe(OH)3(s) + 3H+
(aq) + 3Cl−
(aq)
Para uma solução com 2 mol.L−1 de sulfato de alumínio e 3 mol.L−1 de cloreto férrico, para reação com 100% de rendimento,
tem-se, em mol.L−1, para as equações (I) e (II), respectivamente,
A cinética da reação de brometo de benzila com benzilamina foi estudada por Ravi e colaboradores. Os autores verificaram que a reação é de primeira ordem com respeito a cada reagente.
A reação é esquematizada a seguir:
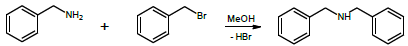
Em um experimento conduzido a 298 K, com excesso de benzilamina, o perfil de decaimento do brometo de benzila foi registrado, sendo apresentado na figura a seguir.
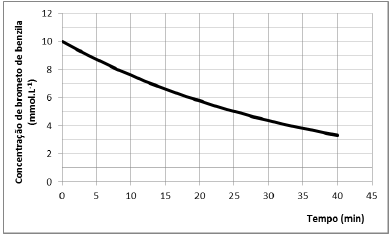
Nessas condições, o tempo (em minutos) em que a concentração
de brometo de benzila terá sido reduzida à 1/8 da concentração
inicial é de
 2N2 (g) + O2(g)
Considere as seguintes afirmações.
I. Na ausência de catalisadores a equação cinética depende da estequiometria dos reagentes.
II. Na presença de platina a velocidade da reação fica inalterada.
III. A reação, na presença de platina, ocorre inicialmente por um processo de adsorção ao metal.
Está correto o que se afirma APENAS em
2N2 (g) + O2(g)
Considere as seguintes afirmações.
I. Na ausência de catalisadores a equação cinética depende da estequiometria dos reagentes.
II. Na presença de platina a velocidade da reação fica inalterada.
III. A reação, na presença de platina, ocorre inicialmente por um processo de adsorção ao metal.
Está correto o que se afirma APENAS em
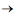 CH4
(g) + 2 H2O(l)
CH4
(g) + 2 H2O(l) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
O ácido lisérgico é um alcaloide a partir do qual se originaram
lisergamidas como a MLD-41, substância com propriedades
psicodélicas. Considerando as estruturas químicas mostradas nas
figuras precedentes, bem como as propriedades físicas e químicas
dos grupos funcionais presentes em suas moléculas, assinale
a opção correta.
Texto 5A3CCC
Considere que, na temperatura T0, a constante de equilíbrio para a reação de decomposição do N2O4 (g) apresentada a seguir seja igual a 4,0 e que o comportamento dos gases envolvidos nessa reação seja ideal. N2O4 (g) + calor » 2NO2 (g)
De acordo com as informações do texto 5A3CCC, se, em determinado instante, na temperatura T0, as pressões parciais de N2O4 (g) e NO2 (g) dentro de uma câmara forem iguais a 0,16 bar e 0,80 bar, respectivamente, então
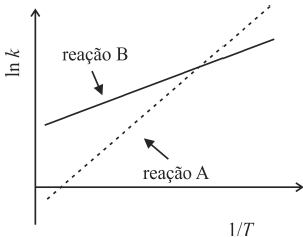
A partir da equação de Arrhenius e do gráfico precedente,
correspondente ao logaritmo neperiano da constante de velocidade
(k) em função do inverso da temperatura (T), em graus kelvin, para
as reações A e B, é correto afirmar que a reação A apresenta
energia de ativação
Texto 5A3AAA
experimento |
concentração inicial (mol.L–1) /S2O82- I- |
velocidade inicial (mol.L-1 .s-1) |
|
1 |
0,15 |
0,20 |
1,1 |
2 |
0,30 |
0,20 |
2,2 |
3 |
0,30 |
0,10 |
1,1 |
A tabela acima apresenta a velocidade inicial da reação seguinte em função das concentrações iniciais dos reagentes. S2O8 2- (aq) + 3 I- (aq) -> 2 SO42- (aq) + I3- (aq)
Texto 5A3AAA
experimento |
concentração inicial (mol.L–1) /S2O82- I- |
velocidade inicial (mol.L-1 .s-1) |
|
1 |
0,15 |
0,20 |
1,1 |
2 |
0,30 |
0,20 |
2,2 |
3 |
0,30 |
0,10 |
1,1 |
A tabela acima apresenta a velocidade inicial da reação seguinte em função das concentrações iniciais dos reagentes. S2O8 2- (aq) + 3 I- (aq) -> 2 SO42- (aq) + I3- (aq)
Para distinguir macroscopicamente entre carbonatos ferrosos e não ferrosos, o indicador mais recomendado é:
