Questões de Concurso
Sobre cinética química em química
Foram encontradas 645 questões
I - Superfície de contato: Quanto menor a superfície de contato, maior a velocidade da reação.
II - Temperatura: Um aumento na temperatura, geralmente, aumenta a velocidade das reações.
III - Catalisadores: São substâncias químicas capazes de acelerar determinadas reações sem serem consumidas durante o processo.
IV - Concentração dos reagentes: Com a diminuição da concentração dos reagentes há um aumento no número de choques efetivos entre suas partículas constituintes, o que resulta em um aumento da velocidade da reação.
Está correto o que se afirma em:
A2 + B2 → 2 AB
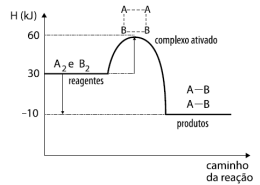
Disponível em: i_662d64349cafcb5b_html_55011cd1.png (463×350) (quimicaevestibular.com.br). Acesso em 27 de Julho de 2021.
Com relação ao gráfico acima, temos as seguintes afirmativas: I. A reação absorve calor; II. A energia de ativação da reação é 60 KJ; III. O valor da entalpia da reação (∆H) é de -40 KJ; IV. Ao colocarmos um catalisador na reação, diminuímos a sua entalpia (∆H), tornando-a mais rápida.
Estão corretas as afirmativas:
I. Ao cortamos a legumes em pequenos pedaços aumentamos a velocidade de cozimento, pois interferimos na energia de ativação da reação.
II. Com o aumento da temperatura, elevamos a agitação térmica das partículas e consequentemente o número de colisões, aumentando a velocidade da reação.
III. A presença de um catalisador altera a entalpia da reação, aumentando a sua velocidade.
IV. Ao mastigarmos mais os alimentos, aumentamos a velocidade da digestão, pois aumentamos a superfície de contato.
Estão corretas as afirmativas:
Consideremos uma reação química representada pela equação química genérica e não balanceada, a seguir.
A + B → A2B
Escreva a equação de velocidade para esta reação genérica. Faça o balanceamento, utilizando mínimos coeficientes inteiros. E considere que as ordens de reação em relação aos reagentes sejam iguais aos seus respectivos coeficientes estequiométricos (mínimos coeficientes inteiros).
Assinale a alternativa que apresenta a equação de velocidade para esta reação genérica, após seu devido balanceamento.
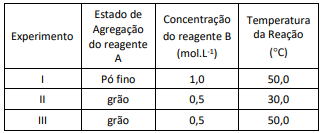
Os experimentos I, II e III, arrumados em ordem crescente de velocidade reacional, serão descritos por


Considerando que a análise do material brasileiro enviado tenha apresentado 5,2x103 desintegrações para o mesmo período de tempo, é possível estimar que a idade da amostra analisada, em anos, é, aproximadamente, igual a
(Dado: log 3,5 = 0,54; log 2 = 0,30)
A respeito de conceitos de química orgânica, julgue o próximo item.
O aumento da concentração de um dos reagentes, em uma reação química, pode aumentar a velocidade da reação.
A respeito de conceitos de química orgânica, julgue o próximo item.
A energia de ativação corresponde à energia que o sistema requer para ir dos reagentes até o estado de transição, sendo
diretamente proporcional à velocidade do processo.
S2O8 2 – (aq) + 3 I – (aq) → 2 SO4 2 – (aq) + I3 – (aq)
A tabela a seguir contém dados experimentais sobre a reação em condições específicas de temperatura e pressão.
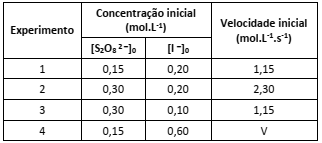
A partir das informações apresentadas é possível prever que a velocidade (V) do Experimento 4 será
As velocidades de reação independem do mecanismo da reação, pois independem do número de espécies colidindo. A expressão da constante de equilíbrio depende apenas da estequiometria, que descreve a relação entre as concentrações de reagentes e produtos quando o sistema atinge o estado de equilíbrio químico.
A velocidade de uma reação química é proporcional às concentrações molares dos reagentes, sendo afetada por fatores como temperatura e presença de catalisadores. Para que uma reação ocorra, são necessárias colisões eficazes, ou seja, colisões com orientação correta e energia suficiente.

A partir das informações do gráfico precedente, que representa
uma reação química genérica do tipo A + 2 B → AB2,
processando-se com velocidade global constante, conclui-se que
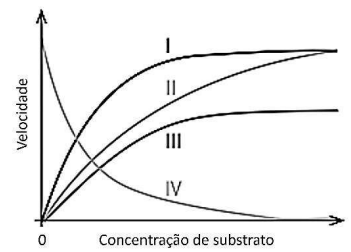
Assinale a afirmativa correta.
[Pt(Cl)(dien)]+ (aq) + I- (aq) → [Pt(I)(dien)]+ (aq) + Cl- (aq)
sendo: Dien = dietilenodiamina.
A respeito da troca de ligante Cl- por I- , é correto afirmar que a lei de velocidade dessa reação será de
Considere o diagrama de energia para a reação X + Y → Z.
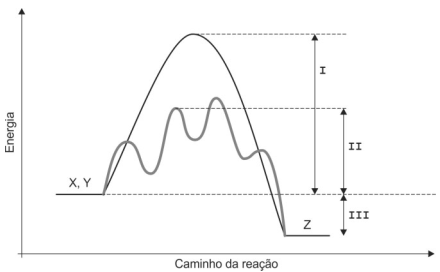
Os intervalos I, II e III representam, correta e respectivamente,
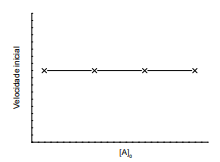
Figura 1. Gráfico da velocidade inicial em função da concentração inicial de A
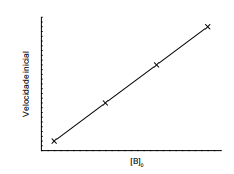
Figura 2. Gráfico da velocidade inicial em função da concentração inicial de B
Com base no procedimento descrito, infere-se que a reação em tela é de ordem
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa
reação apresentem comportamento ideal e que a lei de velocidade
para a reação seja dada pela equação v = k × [SO2Cl2]. Considere
também que, na temperatura em que a reação ocorre (T), a
constante de equilíbrio (Keq) da reação valha 0,40.