Questões de Concurso
Sobre cinética química em química
Foram encontradas 660 questões
O NO produzido na estratosfera pela reação do N2O com o átomo de oxigênio participa da destruição do ozônio na atmosfera.
O NO produzido reage com o ozônio abstraindo um átomo de oxigênio, produzindo o NO2.
Para determinar a expressão da velocidade da reação do NO com o ozônio foram realizados em laboratório, experimentos cujos dados estão na tabela a seguir.
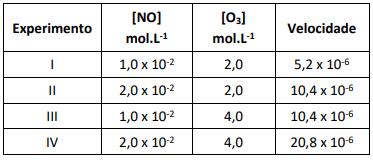
De acordo com os dados, assinale a expressão que descreve a lei da velocidade da reação.
Os catalisadores promovem reações
( ) A lei de velocidade é a equação matemática que exprime como as concentrações interferem na velocidade de uma reação a uma determinada temperatura.
( ) Só é possível determinarmos a ordem de uma reação somando os expoentes a que se devem elevar as concentrações dos reagentes exclusivamente para se obter a lei de velocidade de reação.
( ) Molecularidade é o número de moléculas que se chocam em cada etapa da reação.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
(Dados: C=12; H=1; O=16)
Assinale a alternativa que corresponde a reação de combustão do propano e a velocidade desta reação.
S2O8 –2 + 3 I– → 2 SO4 –2 + I3 –
A velocidade dessa reação, determinada experimentalmente, é expressa por:
v = k.[S2O8 –2].[I–]
Em relação ao exposto, assinale a alternativa que apresenta corretamente a ordem global da reação direta.
H2O2(aq) → H2O (l) + 0,5 O2 (g)
A Tabela abaixo foi construída a partir de dados experimentais e mostra a variação da concentração do peróxido de hidrogênio que vai se decompondo em função do tempo.
[H2O2] mol/L Tempo (min) 1,2 0 1 15 0,6 25 0,4 30 0,2 45 0,1 60
Tabela2. Dados experimentais da decomposição do peróxido de hidrogênio, à 1atm.
Diante do exposto, assinale a alternativa correta utilizando os dados acima.
NO(g) + O3(g) → NO2(g) + O2(g)
Dados cinéticos dessa reação obtidos a T = 298 K foram medidos por técnica de fluxo rápido; alguns desses dados constam no quadro a seguir.

A lei da velocidade para a reação mencionada é:
No que se refere às escalas de temperatura, julgue o item subsequente.
A temperatura pode ser determinada por uma escala
padronizada, equivalente ao conceito de energia do
movimento molecular. O zero absoluto é uma temperatura
em que o movimento das moléculas cessa, sendo esse valor,
na escala absoluta, ou escala Kelvin, igual a −273 K. Na
escala Kelvin, a temperatura absoluta é inversamente
proporcional à energia cinética média de translação das
moléculas de um gás.
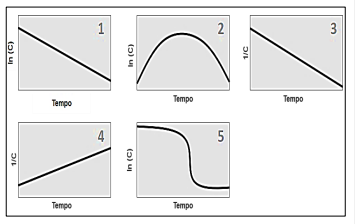
Refere-se a uma equação cinética de primeira ordem o(s) gráfico(s) indicado(s) apenas pelo(s) número(s)
Com base nessas informações, julgue o próximo item.
A lei de velocidade de reações que ocorrem em muitas
etapas é determinada pela reação global e, no caso da
degradação do ozônio, ela é igual a ν = k [O3]
2
[O2]
3
, em que
ν representa a velocidade da reação, k, a constante de
velocidade e [O3] e [O2], as concentrações em quantidade de
matéria de O3 e O2, respectivamente.
Com base nessas informações, julgue o próximo item.
A espécie O (g) é o catalisador da reação.
Com base nessas informações, julgue o próximo item.
A reação da etapa II do mecanismo proposto ocorrerá se a
energia potencial do complexo ativado for menor que a dos
reagentes.
Com base nessas informações, julgue o próximo item.
Se a taxa de produção de oxigênio (d[O2]/dt) for igual a
3,0 × 10−5 mol/s, a taxa de consumo de ozônio (d[O3]/dt)
será igual a −2,0 × 10−5 mol/s.
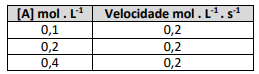
A partir das informações, a Lei de Velocidade para esta reação será de:
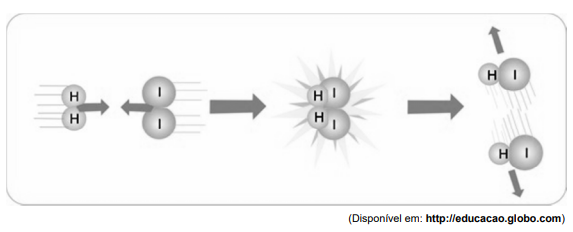
A formação do complexo ativado
I - d[R]/dt = k[R]
II - [R] = [R]oe-kt
III - [R] = [R]o - kt
IV - d[I]/dt + k[I] = k[R]oe-kt
Quais estão corretas?
Considerando os aspectos termoquímicos, julgue o item que se segue.
A temperatura e a mudança do estado físico não influenciam
a variação de entalpia de uma reação química.
X KO2(s) + Y CO2(g) ⇔ W K2CO3(s) + Z O2(g).
Calcule a massa de KO2 necessária para reagir com 50 l de CO2 a 25°C e 1,0 atm. A massa molar do KO2 é 71,1 g/mol. Considere o volume molar 24,5l/mol.
Assinale a alternativa que contém os valores de X, Y, W e Z e a massa de KO2 consumida na reação.
