Questões de Concurso
Sobre cinética química em química
Foram encontradas 829 questões
A seguir são apresentados dados experimentais de uma reação de obtenção do gás hidrogênio.
2 H2(g) + 2 NO(g) → 1 N2(g) + 2 H2O (l)
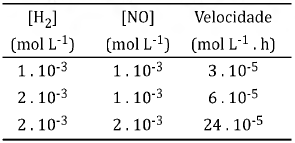 Fonte: Canto (1998).
Fonte: Canto (1998).
Baseado nos dados experimentais apresentados na tabela, marque a alternativa que apresenta a ordem da reação em relação a H2 e NO, respectivamente.
O sulfato de bário, substância muito utilizada em exames radiológicos, pode ser obtido por meio de uma reação entre o ácido sulfúrico e o hidróxido de bário, conforme reação equacionada a seguir:
Ba(OH)2(aq) + H2SO4(aq) → BaSO4(s) + H2O(l)
Considerando que a reação tem um rendimento de 80%, a massa, em gramas, de sulfato de bário obtido, quando são utilizados 0,05 kg de hidróxido de bário, será aproximadamente de:
Massas atômicas: H = 1; Ba = 137; S = 32; O = 16.
O reagente limitante de uma reação é o reagente que determina o rendimento máximo do produto. Identifique o regente limitante e o excesso, da seguinte reação, sabendo que: 2 mols de A reagem com 8 mols de B para formar 2AB3.
A2 + 3B2 → 2AB3
Na seguinte tabela, são apresentados os dados referentes a três experimentos de combustão do monóxido de carbono, conduzidos à temperatura de 300 K, em atmosfera padrão.
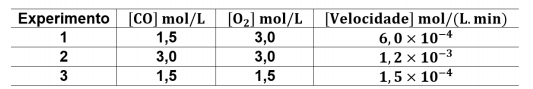
Com base nesses experimentos, a ordem global da reação é igual a
Uma reação do tipo 2A(g) + Z(g) →2T(g) foi monitorada variando-se a concentração dos reagentes. A velocidade de formação de T foi medida conforme a tabela abaixo.
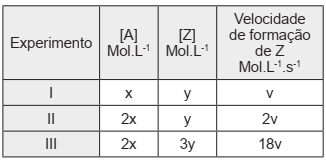
Determine a lei de velocidade e calcule a velocidade da reação em função de v se [A] for x e [Z]
for 3y.
Considerando-se USBERCO e SALVADOR, sobre as transformações da matéria, assinalar a alternativa que preenche as lacunas abaixo CORRETAMENTE:
Quando ocorre um(a) _______________, uma ou mais substâncias se transformam e dão origem a novas substâncias. Desta forma, diz-se que ocorreu um(a) ____________.
As fórmulas químicas são usadas para representar as substâncias, sendo que, qualitativamente, a fórmula representa o nome da substância. Quantitativamente, sua fórmula representa a molécula ou a fórmula unitária da substância. Considerando essas informações e as massas molares: carbono (C) = 12 g mol−1; oxigênio (O) = 16 g mol−1; e cálcio (Ca) = 40 g mol−1, assinale a alternativa que apresenta a fórmula centesimal dos elementos que compõem o carbonato de cálcio.
Uma amostra mineral, possui 70 % (em massa) de fosfato de cálcio é tratada com ácido sulfúrico a fim de se obter fertilizante fosfatado, Ca(H2PO4)2. A reação é representada pela equação:
Ca3(PO4)2 + 2 H2SO4 + 4 H2O → Ca(H2PO4)2 + 2 CaSO4 . 2H2O
Considerando que as impurezas da amostra mineral não reagem com o ácido sulfúrico, indique a alternativa que apresenta a massa deste ácido necessária para reagir com 30,0 Kg da amostra mineral.
Analise as proposições a seguir e indique a CORRETA:
Um elemento hipotético X apresenta três isótopos, X24, X25, X26, com as seguintes abundâncias relativas: 80%, 10% e 10%, respectivamente. Sabendo disso, assinale a alternativa que indica a massa atômica do elemento X.
O ozônio pode ser removido do ar fazendo-se o ar passar por uma solução de iodeto de sódio, que reage com o ozônio de acordo com a seguinte reação não balanceada:
O3 (g) + NaI (aq) + H2O (l) → O2 (g) + I2 (s) + NaOH (aq)
Quantos gramas de iodeto de sódio são necessários para remover 0,02 mol de O3 do ar?
Assinale a alternativa que apresenta a família e o período da Tabela Periódica em que está localizado o elemento cujos números quânticos do elétron mais energético do cátion monovalente são: n = 4, l = 2, m = + 2, s = + ½. Considere s = - ½ para o primeiro elétron do orbital.
Considere as substâncias A, B, C, D, componentes da equação A + B → C + D. Quando 10 g de A reagem com excesso B, são obtidos 5 g de C e 8 g de D. Se 50 g de A forem misturados a 30 g de B, em condições adequadas para reagir, qual a máxima massa de C pode ser obtida?
Uma massa de 1,08 g de prata (massa molar 108 g/mol) foi depositada a partir de uma solução de cloreto de prata, passando uma determinada carga elétrica. Essa mesma carga foi utilizada na deposição de 0,657 g de um metal (X) desconhecido (massa molar 197 g/mol) a do cloreto fundido deste metal. Com base nestas informações, indique a alternativa que apresenta a correta fórmula do cloreto metálico em questão.
O Urânio 235 sofre fissão por meio da reação representada a seguir:
92U235 + 0n 1 → 56B142 + ZX A + 2 0n1
Indique a alternativa que apresenta os corretos valores do número atômico (Z) e número de massa (A) do átomo X.
Em I, adicionou um comprimido efervescente inteiro em água a 25ºC. Em II, adicionou metade de um comprimido efervescente em água a 25º C. Em III, adicionou um comprimido efervescente inteiro em água a 90ºC. Em IV, adicionou metade de um comprimido efervescente em água a 90º C.

O copo em que a dissolução do comprimido foi mais rápida e os fatores que a justificam estão devidamente corretos é:
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) O valor numérico da constante de equilíbrio de reações químicas sofre alteração quando há variação da temperatura da reação.
( ) A velocidade de reações químicas é alterada pela presença de catalisadores e estes (catalisadores) são totalmente consumidos durante a reação.
( ) A diminuição da temperatura de uma reação exotérmica desfavorece a formação de produtos.
( ) O tempo necessário para que a concentração do reagente se reduza a um quarto da concentração inicial é denominado de meia-vida.
( ) As leis de velocidades são determinadas experimentalmente e geralmente não podem ser escritas a partir da estequiometria da equação química da reação.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Considere certa reação química, representada pela equação genérica abaixo:
A + B → Produtos
Na temperatura de 20°C, apresenta um lei de velocidade (V1 ), V1 = k.[A].[B].
Qual será a sua lei de velocidade (v2 ) na temperatura de 30°C, admitindo-se que essa reação obedece ao princípio de Van’t Hoff, nas mesmas concentrações iniciais dos reagentes.