Questões de Concurso
Sobre cinética química em química
Foram encontradas 660 questões
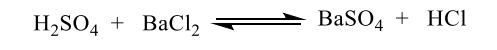
Com referência aos conceitos de equilíbrio químico, julgue o item.
O catalisador não altera a composição do equilíbrio químico.
Dada a reação hipotética:

A partir de dados experimentais, verifica-se que o composto A é um reagente de terceira ordem e a substância B é um reagente de primeira ordem da reação.
Se duplicarmos as concentrações dos reagentes A e B, a
velocidade dessa reação aumentará:
Sobre essa lei conclui-se que, para uma reação em meio gasoso, a constante de velocidade
A relação entre essas grandezas é expressa por
Em um experimento, realizou-se um estudo cinético da seguinte reação química:
2 N2 O5 (g) → 4 NO2 (g) + O2 (g)
Esse estudo indicou que essa é uma reação química de
primeira ordem e que a constante de velocidade é igual
a 3,4 x 10-4 s-1 a 25ºC.
Para uma concentração de N2
O5
igual a 0,2 mol L-1
, a
velocidade da reação, em mol L-1
s-1
, corresponde a
Em uma síntese industrial, o HBr é produzido a partir da seguinte reação química:
H2 (g) + Br2 (g) → 2 HBr (g)
No início da síntese, a concentração de H2
era de 0,3 mol/L.
Após 20 minutos, sua concentração passou a 0,1 mol/L.
Nesse intervalo de tempo, a velocidade média de formação de HBr, em mol L-1
min-1
, correspondeu a
No gráfico abaixo estão representados os caminhos de uma reação com catalisador e uma sem catalisador.
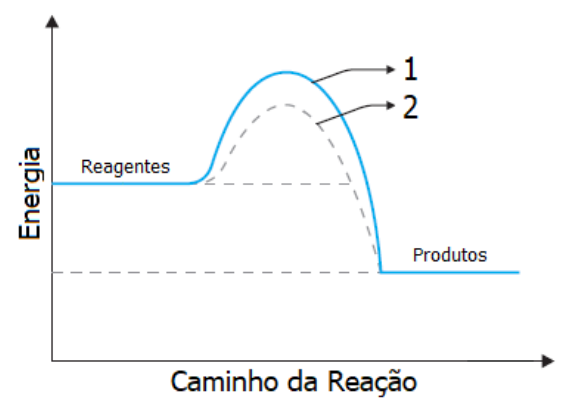
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) com base nesse gráfico.
( ) A curva 1 refere-se à reação não catalisada e a curva 2 refere-se à reação catalisada.
( ) A energia de ativação da curva 1 é maior do que a da curva 2.
( ) A utilização de um catalisador na reação aumenta o valor de ∆H.
( ) O complexo ativado da curva 1 apresenta a mesma energia do complexo ativado da curva 2.
( ) Se a reação seguir o caminho da curva 2, ela será mais rápida.
Assinale a alternativa que indica a sequência correta,
de cima para baixo.
CuS + HNO3 ➔ Cu(NO3)2 + S + NO + H2O
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) em relação à reação dada.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
( ) A soma total de íons entre os produtos deve ser igual à soma total de íons entre os reagentes.
( ) O agente oxidante é o HNO3 e o agente redutor é o CuS.
( ) O total de elétrons cedidos pelo agente redutor deve ser igual ao total de elétrons recebidos pelo agente oxidante.
( ) Os coeficientes 3, 8, 3, 3, 2, 4 tornarão a equação balanceada.
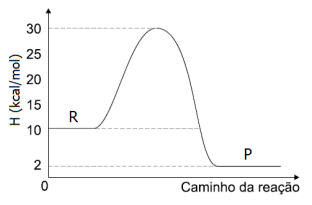
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ) com as informações fornecidas pelo gráfico.
( ) A energia dos reagentes é igual a 30 kcal/mol e a dos produtos é igual a 2 kcal/mol.
( ) O gráfico representa uma reação exotérmica onde são liberadas 8 kcal/mol de energia.
( ) A energia de ativação da reação é igual a 30 kcal/mol e a energia do complexo ativado é igual a 10 kcal/mol.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Br2(aq) + HCOOH(aq) → 2Br- (aq) + 2H+ (aq) + CO2(g)
Sabendo-se que a concentração inicial do bromo é 0,120 mol L-1 e que, após 200 s, diminui para 0,060 mol L-1 , determina-se que a constante de velocidade da reação, em s-1, é igual a
Catalisadores são substâncias utilizadas para aumentar a energia de ativação de reações químicas.
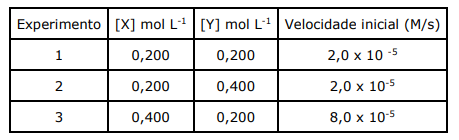
Com base nos dados da tabela, analise as assertivas abaixo:
I. A lei de velocidade para a reação é v= k [X]2 .
II. A concentração de Y não tem nenhum efeito sobre a velocidade da reação.
III. A ordem global da reação é 3.
IV. A constante de velocidade da reação é 2,0 x 10-3 M-1s-1.
Quais estão corretas?
Tabela: Dados obtidos na investigação cinética (método da velocidade inicial) para a reação: 2 A2B(g) → 2 A2(g) + B2(g).
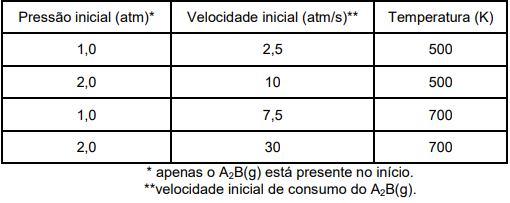
Diante das informações acima, assinale a opção que mostra A VELOCIDADE DA REAÇÃO (em termos de consumo do A2B(g)), em atm/s, quando a pressão de A2B(g) é igual a 1,5 atm à temperatura de 600 K:
Figura: Dados cinéticos para uma reação de primeira ordem. Concentração versus tempo e velocidade versus tempo.
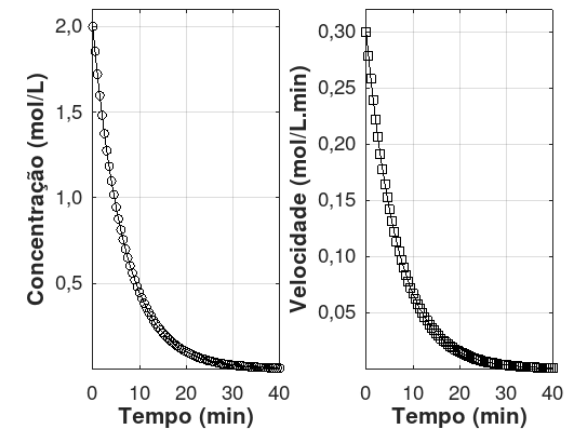
A partir da interpretação dos gráficos mostrados acima, assinale a opção que mostra corretamente O VALOR DO TEMPO DE MEIA-VIDA do processo, em minutos, com precisão de duas casas decimais: Dado: considere ln(2) = 0,693.