Questões de Concurso
Sobre cinética química em química
Foram encontradas 829 questões
O Ca(ClO)2 apresenta, em sua estrutura, ligações covalentes e ligações metálicas.
A molécula de HCRO apresenta geometria linear.
Nas mesmas condições de temperatura e pressão, a água de uma piscina tratada com Ca(ClO)2 evapora mais lentamente do que a água pura.
A dissolução de 0,010 mol de Ca(ClO)2 em 1,0 L de água pura, à temperatura T, gera uma concentração de equilíbrio de HClO superior a 1,0 × 10 -3 mol/L.
A dissolução de 715 g de Ca(ClO)2 em 100.000 L de água pura gera uma solução com concentração analítica de cálcio superior a 2,0 × 10 -5 mol/L.
O íon Ca2+ é formado pela adição de dois prótons ao átomo de cálcio.
Na reação de hidrólise da água, o íon ClO- atua como uma base de Brønsted-Lowry e também como uma base de Lewis.
Em uma solução onde o sal é adicionado à água, o sal será o:
Podemos afirmar que seus constituintes estarão em equilíbrio químico quando:
N2O5 (g) → 2 NO2(g) + 1/2 O2(g)
A constante de velocidade desta reação é igual a 1,38 x 10-5 s-1 a uma dada temperatura. Se a concentração inicial do N2O5 for 4,0 x 10-3 mol L-1,em quanto tempo aproximadamente a concentração cai até 1,0 x 10-3 mol L-1 ?
Dados: ln 2,5 = 0,916; ln 10-1 = -2,302
2A(g)+ 3B(g) → A2 B 3(g)
De um conjunto de experimentos foram coletados dados e estes, organizados na seguinte tabela:

Se o mesmo experimento for realizado com a hexocinase, mas na presença de quantidades saturantes de um de seus substratos, pode-se esperar o seguinte resultado:
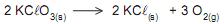
Sendo o volume molar igual 22,4 L/mol (na condição normal de temperatura e pressão), o volume máximo de oxigênio que pode ser obtido a partir da decomposição de 4,00 mol de KCLO3 , com o rendimento percentual de 90%, em L, é
Sendo k a constante de velocidade, a lei de velocidade do decaimento radioativo do carbono-14 é representada pela equação
A tabela a seguir fornece os dados cinéticos obtidos para a reação 2ICl(g) + H2(g) → I2(g) + 2 HCl(g)
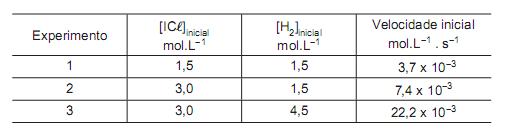
A partir dos dados experimentais obtidos, a expressão da velocidade para essa reação é
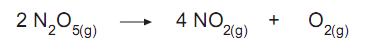
Dois experimentos foram feitos visando a obter informação sobre a cinética de reação. Os resultados das experiências estão no quadro abaixo.

A partir dos dados do quadro, conclui-se que a expressão da lei de velocidade de decomposição do
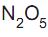 é
é
Com relação à reação em apreço e considerando-se condições em que a lei de velocidade acima apresentada é, de fato, obedecida, julgue os itens seguintes.
Para a reação apresentada,
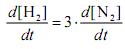 .
. 
Com relação à reação em apreço e considerando-se condições em que a lei de velocidade acima apresentada é, de fato, obedecida, julgue os itens seguintes.
A reação acima é elementar, ou seja, processa-se em uma única etapa.

