Questões de Concurso
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 991 questões
Por exemplo, pode-se produzir 448cm3 de H2 nas CNTP reagindo alumínio (peso molecular de 27g) com excesso de uma solução aquosa de HCl, desde que seja usada a seguinte quantidade de átomos de alumínio:
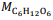 = 180 g/mol e
= 180 g/mol e 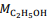 = 46 g/mol.
= 46 g/mol. De acordo com a reação descrita, para a obtenção de 1,0 kg de etanol, são necessários mais de 2,0 kg de glicose.
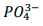 foi precipitado como Ag3PO4 a partir da adição
de 20mL de AgNO3 0,4mol.L-1. O excesso de AgNO3 foi retrotitulado com 5,2 mL de KSCN 0,17 mol.L-1. A
porcentagem aproximada de fósforo na amostra de
fertilizante é
[Ma(u): Ag = 108; K = 39; S = 32; P = 31; O = 16; N= 14; C =
12]:
foi precipitado como Ag3PO4 a partir da adição
de 20mL de AgNO3 0,4mol.L-1. O excesso de AgNO3 foi retrotitulado com 5,2 mL de KSCN 0,17 mol.L-1. A
porcentagem aproximada de fósforo na amostra de
fertilizante é
[Ma(u): Ag = 108; K = 39; S = 32; P = 31; O = 16; N= 14; C =
12]: Reação de combustão completa do butano (não balanceada):
C4H10 (g) → CO2 (g) + H2O (I) ΔHcº = 2.808 kJ/mol
Dados: Massas Molares em g/mol: H =1; C =12; O = 16
Al(OH)3(s) + 3 HCl(aq) → AlCI3(aq) + 3 H2O(I)
Mg(OH)2(s) + 2 HCl(aq) → MgCl2(aq) + 2 H 2O(I)
No período de 18 horas, a massa de ácido clorídrico neutralizado em miligramas e a quantidade de moléculas de HCl consumida, na neutralização, foram respectiva e aproximadamente:
Dados: Massas Molares: Mg(OH)2 = 58 g/mol; Al(OH)3 = 78 g/mol; HCl = 36,5 g/mol; Constante de Avogadro = 6,0.1023
3 Fe2O3(s) → 2 Fe3O4(s) + 1/2 O2(g)
A porcentagem de Fe e a porcentagem de Fe3O4 presentes na amostra, são respectiva e aproximadamente:
Dados: Fe = 55,847 g/mol; Fe2O3 = 159,69 g/mol Fe3O4 = 231,54 g/mol
P2O5(S) + 9 H2O(I) → 2PO43- (aq) + 6 H3O+(I)
2 PO43-(aq) + 6 Ag+(aq) → 2 Ag3PO4(S)
Ag+(aq) + SCN-(aq) → AgSCN(s)
Sendo assim, a porcentagem de P2O5 presente na amostra é, aproximadamente, igual a:
Dados: Massas molares em g/Mol C = 12,01 N = 14,00; O = 16,00; P = 30,97; S = 32,06; Ag = 107,87

Supondo que um carro de porte pequeno possua um tanque de combustível de 40 L, a quantidade de gás O2, em quilogramas, que necessita para queimar 40 L de C8H18, bem como a quantidade de CO2 produzida durante a queima, em quilogramas, serão, respectiva e aproximadamente:
Dados: Massas molares em g/L moL: H = 1; C = 12; O = 16; Densidade da gasolina durante a combustão: 0,692 g/cm3
2Li2O2(s) + 2CO2(g) → 2Li2CO3(s) + O2(g)
Se 88 L de gás carbônico forem absorvidos pelo peróxido de lítio, qual será o volume de oxigênio liberado?
Reação de combustão do metano:
CH4(g) + 2 O2(g) → CO2(g) + 2 H2 O(g) ΔH = - 890,4 kJ/mol
(Dados em g/mol: C=12, H=1, O=16, N=14, P=31)
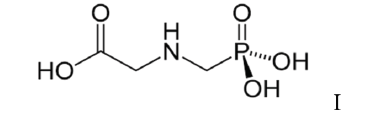 Uma amostra de 1 t de trigo estocada em um armazém, no sul do Brasil, apresentou 0,1 mol de glifosato. De acordo com os dados apresentados, percebe-se que o valor encontrado foge ao que é permitido no Brasil, e o número de vezes que é superior pode ser representado por:
Uma amostra de 1 t de trigo estocada em um armazém, no sul do Brasil, apresentou 0,1 mol de glifosato. De acordo com os dados apresentados, percebe-se que o valor encontrado foge ao que é permitido no Brasil, e o número de vezes que é superior pode ser representado por:
Etapa I: CaCO3 (s) → CaO(s) + CO2(g)
Etapa II: CaO(s) + C(graf) → CaC2(s) + CO2(g)
Etapa III: CaC2(s) + H2O(l) → Ca(OH)2(aq) + C2 H2(g)
Partindo de uma amostra de 1260,0 g da calcita, com 12% de impurezas e um rendimento de 94%, o volume de acetileno produzido nas CNTP é:
(Dado, em g/mol: Ca = 40, C = 12, O = 16)
Na expressão 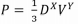 na qual P, D e V
representam pressão, densidade e velocidade,
respectivamente, os valores de X e Y, sendo a
expressão dimensionalmente correta, são os
seguintes:
na qual P, D e V
representam pressão, densidade e velocidade,
respectivamente, os valores de X e Y, sendo a
expressão dimensionalmente correta, são os
seguintes: