Questões de Concurso
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 971 questões
O peróxido de hidrogênio, H2O2, quando em contato com um ferimento na pele, é decomposto pela enzima catalase, liberando água e gás oxigênio, conforme reação a seguir.
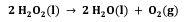
Considerando que 1,3 L de H2O2 (densidade = 1,00 g/mL) se decompõe a 40 °C e pressão de 1,0 atm, assinale a alternativa que apresenta o volume aproximado de gás oxigênio produzido.
Dados:
MM (H2O2) = 34 g/mol.
C = K (Kelvin) – 273
R = 0,082 L.atm/mol.K
(Disponível em: https://jovempan.com.br/noticias/brasil/gas-de-cozinha-atinge-maior-preco-em-2021-e-deve-ficar-ainda- mais-caro-entenda-o-reajuste-da-petrobras.html. Acessado em 28/09/2021)
Supondo que todo o GLP presente no botijão seja somente butano e está totalmente na forma líquida, e que o preço do botijão de gás seja de R$ 125,00, para uma família que teve um gasto mensal com a fatura de gás de R$ 55,77, qual a quantidade de energia que foi liberada, em quilojoules, na queima do gás butano?
A reação de combustão completa do butano (não balanceada):
C₄H₁₀(g) → CO₂ (g) + H₂O ∆H°C = 2.808 kJ/mol
A ureia ((NH2)2CO) é um composto orgânico, sólido, cristalino e solúvel em água. Ela tem diversas aplicações, como na alimentação de bovinos, estabilizador de explosivos, produção de resinas e medicamentos e até nas sínteses de fertilizantes agrícolas.
Um dos meios de se obter a ureia e água é pela reação entre gás carbônico e amônia, nas condições adequadas.
Com base no texto, é correto afirmar que:

Abaixo está representado um frasco contendo água e clorofórmio, dois líquidos imiscíveis.

A propriedade que explica o fato de o clorofórmio
corresponder a fase inferior e a água a fase superior
do sistema chama-se:
Disponível em:<https://www.campograndenews.com.br/cidades/interior/seis-cidades-de-ms-vao-ter-fluor-na-agua-encanada-a-partirde-agora >. Acesso em: 02 nov. 2021.
A fluoretação é utilizada no Brasil desde 1953. Atualmente o recomendado é 0,7 mg/L de fluoreto na água. Considerando que a fluoretação ocorre por meio da adição de fluoreto de sódio, podemos afirmar que a massa aproximada desse sal para fazer a fluoretação de 1 m3 de água é
Dados: Massas molares (g/mol) Na = 23; F = 19.
KClO3(s) → KCl(s) + 3/2O2(g)
Essa sua propriedade é frequentemente usada em laboratórios de ensino secundário e superior para produzir gás oxigênio. Nas CNTP, uma amostra de 136 g desse sal com pureza de 90%, em uma decomposição com rendimento de 80%, libera aproximadamente qual volume de gás?
Dados: KClO3 = 122,5u
Volume molar CNTP = 22,7 L
Adaptado.Produção de Alumínio: Extração da Bauxita, Obtenção na Eletrólise (culturalivre.com). (Acesso em 24 de Julho de 2021).
Podemos resumir a reação de obtenção do alumínio a partir do óxido de alumínio por meio da seguinte equação química balanceada. 2 Al2O3 (l) + 3 C(s) → 4 Al (l) + 3 CO2 (g) Dados: Massas atômicas (g/mol) Al=27; C=12; O=16. Assinale a alternativa que apresenta a massa, em gramas, de alumínio produzida se tivermos o triplo da quantidade, em mol, de óxido de alumínio e carvão.
Atenção: a Tabela abaixo deve ser usada como apoio para responder a questão de Química.
10KNO3(s) + 8C(s)+ 3S(s) ➝ 5N2(g) + 6CO2(g) + 2K2CO3(s) + 3K2SO4(s)
Durante um teste envolvendo a queima de pólvora negra ao ar, foram recolhidos 75L de gás nitrogênio. Sabendo que o rendimento do processo foi de 100%, é correto afirmar que a massa de pólvora negra, em grama, usada no teste foi de
(Dado: volume molar = 25 L.mol-1 )
O elemento X é o


4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
Na segunda etapa, o óxido nítrico (NO) formado, quando exposto ao ar, se oxida rapidamente dando origem ao dióxido de nitrogênio (NO2):
2NO(g) + O2 → 2NO2(g)
Na terceira etapa, o NO2, quando dissolvido em água, forma o ácido nítrico como descrito na reação a seguir:
3NO2(g) + H2O(l) → 2HNO3(aq) + NO(g)
A quantidade máxima de ácido nítrico, em kg, que pode ser obtida a partir de 10.000 L de amônia é igual a
(Dado: volume molar = 25,0 L.mol-1)
A respeito de conceitos de química orgânica, julgue o próximo item.
O estado estequiométrico é atingido, em uma reação química, quando as concentrações de reagentes e produtos não se alteram
mais.
O número de átomos de carbono presentes na fórmula molecular do flurbiprofeno é igual a
• 2KClO3 (s) → 2 KCl (s) + 3 O2 (g) • 2 KHCO3 (s) → K2O (s) + H2O (g) + 2 CO2 (g) • K2CO3 (s) → K2O (s) + CO2 (g)
Nas condições reacionais empregadas, o rendimento foi de 100% e produziu 1,80 g de água, 19,2 g de gás oxigênio e 22,0 g de gás carbônico.
Os percentuais aproximados de KClO3, KHCO3 e K2CO3 na amostra inicial são, respectivamente, iguais a
Em uma reação de neutralização, o reagente consumido em primeiro lugar é chamado de reagente limitante. A quantidade mínima de produto que pode ser formada depende da quantidade inicial desse reagente; o reagente presente em quantidade superior à necessária para reagir é chamado de reagente em excesso. Esse tipo de reagente em quantidade superior é totalmente utilizado pela reação, de modo que é inteiramente consumido.
A abordagem das reações químicas em solução pode ser realizada de modo quantitativo; no entanto, em razão da interpretação das equações químicas em termos de relações quantitativas, os cálculos estequiométricos impedem a previsão das quantidades de reagentes e produtos nas reações químicas.

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item.
Assumindo-se que todo o monóxido de carbono
foi consumido na conversão da hematita para o ferro
e que essa reação foi completa e sabendo-se que
MFe = 56 g/mol e M(Fe2O3) = 160 g/mol, é correto
concluir que a quantidade, em gramas (g), de ferro
obtida a partir de 0,48 kg de Fe2O3 é superior a 400.