Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 961 questões
O iso-octano é o constituinte que está em maior proporção na gasolina automotiva. Para que a combustão desse hidrocarboneto seja completa, de acordo com a equação, qual será a razão molar
C8H18 : O2?
Considere a equação não balanceada
C8H18(l) + O2(g) → CO2(g) + H2O (g)
Um laboratório recebeu uma amostra de calcário para que fosse analisado o seu grau de pureza. Pela decomposição de 240 g de calcário, foram produzidos 107 g
CaCO3 (s) → CaO (s) + CO2 (g)
A pureza encontrada, em percentagem, teve seu
valor mais próximo de
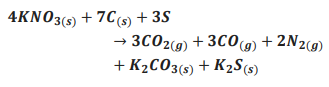
A expansão dos gases gerados nessa reação causa o efeito explosivo da pólvora. Considere uma munição com 10,10 g de pólvora reagindo de acordo com a equação acima, porém com somente 60% do salitre presente sofrendo essa reação. Assinale a alternativa que apresenta a quantidade de mols de gases gerados no disparo dessa munição?
MM (K=39 g/mol; N=14 g/mol; O=16 g/mol; C=12 g/mol; S=32 g/mol)
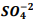 seguindo a reação: BαSO4(s) ⇔
seguindo a reação: BαSO4(s) ⇔ 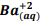 +
+ 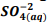 , onde Kps = [ Bα+2] [
, onde Kps = [ Bα+2] [ 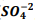 ] = 1, 1 x10−10. Verifica-se que:
] = 1, 1 x10−10. Verifica-se que: I. A partir da concentração de
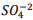 acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4.
acima de0,025M inicia a precipitação de Ba+2. II. Em concentrações menores que 4,4 x10−9 M jáhouve precipitação de BαSO4. Assinale a alternativa correta:
CH3CO2H(aq) + OH-(aq) ⇔ CH3CO2-(aq) + H2O(l)
Para atingir o ponto de equivalência foram gastos 5,3 x10-6 M de OH- e o pH ficou em 8,72.
Analise as afirmativas a seguir e dê valores Verdadeiro (V) ou Falso (F).
( ) No ponto de equivalência o pH é neutro. ( ) No ponto de equivalência, o pH é ligeiramente básico, porém a partir desse ponto, a adição de mais NaOH torna a solução substancialmente básica.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
X KO2(s) + Y CO2(g) ⇔ W K2CO3(s) + Z O2(g).
Calcule a massa de KO2 necessária para reagir com 50 l de CO2 a 25°C e 1,0 atm. A massa molar do KO2 é 71,1 g/mol. Considere o volume molar 24,5l/mol.
Assinale a alternativa que contém os valores de X, Y, W e Z e a massa de KO2 consumida na reação.
Reação: 6CO2(g) + 6H2O(l) ⇔ C6H12O6(g) + 6O2(g).
Considere massa molecular da glicose = 180 g/mol e volume molar = 24,5 l/mol.
Assinale a alternativa que contém a resposta correta.
Assinale a alternativa que contenha a concentração no equilíbrio de H2(g), I2(g) e HI respectivamente:
5 µg g-1, 10 µg g-1, 20 µg g-1, 25 µg g-1 e 50 µg g-1.
Para isso, esse técnico partiu de uma solução estoque de 1 mg g-1.
Assinale a alternativa que demonstra a quantidade mínima de solução estoque que é necessário para se conseguir preparar todas as amostras sem ter que fazer uma diluição intermediária, sendo que o volume final de cada uma das amostras foi 10 ml.
I. Misturando-se as soluções Fe2(SO4)3 e hidróxido de sódio, forma-se um precipitado. II. Misturando as soluções AgNO3 e carbonato de potássio, forma-se um precipitado. III. Misturando as soluções MgCO3 e sulfato de sódio, forma-se um precipitado.
A partir da análise das asserções anteriores, assinale a alternativa correta.
Suponha que um automóvel tenha um consumo de 10 km/l, utiliza somente gasolina e leva 1 pessoa somente. Os ônibus possuem um consumo de 4 km/l, levam 40 passageiros e está andando cheio no percurso estudado. Ambos andam em seu percurso, 20 km.
Leve em consideração que a fórmula da gasolina seja somente C8H10 e o diesel seja somente C14H30. Massa molar: C8H10=114 g/mol, C14H30= 198 g/mol e CO2=44 g/mol (para facilitar seu cálculo: 8 mol de CO2=352 g e 14 mol CO2=616 g. Densidade da gasolina: 0,7g/ml e diesel: 0,8g/ml.
Com essas informações em mãos, analise as afirmativas a seguir.
I. O automóvel emite mais CO2 que o ônibus. II. O ônibus emite mais CO2 que o automóvel. III. Em termos per capita, o motorista do carro emite mais CO2 que os passageiros do ônibus. IV. Em termos per capita, os passageiros do ônibus emitem mais CO2 que o motorista do carro. V. Com esses dados em mão, mostra-se que políticas públicas são acertadas para diminuição de gás carbônico na atmosfera. VI. Pelos dados calculados, mostra-se que as políticas públicas não fazem diferença nas emissões de gás carbônico.
Estão corretas as afirmativas:
I. 250 ml da solução de H2SO4(aq) 2 M. II. 6 l de uma solução H2SO4(aq) 0,5 M.
O volume aproximado de H2SO4(aq) 17,8 M necessário para preparar essa aula é:
1) Dissolvendo-se em água 51,0 g em um balão de 250 ml (completado até a marca). 2) Em seguida, uma amostra de 2,00 ml desta solução foi transferida para um balão volumétrico de 100 ml e diluída com água até a marca. 3) Uma segunda diluição foi feita a partir da solução do item 2, transferindo-se 125 ml para um balão de 250 ml e diluída com água até a marca.
Com esses dados em mãos, analise as afirmativas a seguir.
I. A concentração final da solução na Etapa 1 é de 8 mol.l-1. II. A concentração da solução após a primeira diluição (Etapa 2) é aproximadamente 0,016 mol.l-1. III. A concentração da solução após a segunda diluição (Etapa 3) é aproximadamente 0,008 mol.l-1.
Estão corretas as afirmativas:
Assinale a alternativa que contém a massa (em gramas) necessária para produzir 500 mL solução estoque.
Considere a estrutura química da testosterona.
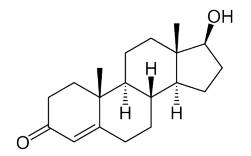
A massa molar para a estrutura química fornecida na imagem será, aproximadamente, de:
Dados de massas molares: C = 12 g/mol, H = 1 g/mol e O = 16 g/mol.
A sequência de reações que ocorrem no momento da coleta é:
• Mn2+ + 2 OH- → Mn(OH)2 • 2Mn(OH)2 + O2 → 2 MnO(OH)2
Já no laboratório, a solução é acidificada e o precipitado édissolvido:
• MnO(OH)2 + 4 H+ → Mn4+ + 3 H2O • Mn4+ + 2 I- → Mn2+ + I2
O iodo formado é titulado com tiossulfato permitindo adeterminação do O2.
Nesta sequência de reações, 1 mol de I2titulado equivale a
Nesta temperatura, a constante de equilíbrio, Kc, vale 4.
O número de mols de acetato de etila presente no meio reacional após o equilíbrio ter sido atingido será, aproximadamente, igual a
0,700g de amostra foi digerido e alcalinizado com excesso de solução de hidróxido de sódio. Após destilação, a amônia foi coletada em 25,00mL de solução de ácido sulfúrico 0,0750mol L–1. A titulação do excesso do ácido requereu 5,00mL de solução de hidróxido de sódio 0,1250 mol L–1.
[Dados: Massa molar do nitrogênio = 14 g mol–1.]
O teor de nitrogênio na amostra é de
O preparo de uma solução envolveu as seguintes etapas:
1. Transferência de 5,0mL de solução aquosa de cloreto de magnésio 1,90 g L-1 a balão volumétrico de 25,0mL.
2. Adição de 10,0mL de solução aquosa de sulfato de sódio 0,015 mol L-1 ao mesmo balão.
3. O volume da solução final no balão volumétrico foi completado à 25,0mL como água destilada.
[Dados: massas molares (em g.mol–1 ). Mg: 24; Cl: 35,5; Na: 23; S: 32; O: 16.]
A concentração total de cátions, em mol L–1, na solução final será
de