Questões de Concurso
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 961 questões
Após a leitura, assinale a opção que mostra O SOMATÓRIO DOS COEFICIENTES ESTEQUIOMÉTRICOS, expressos com os menores inteiros, da reação citada na etapa 1 acima, A GEOMETRIA MOLECULAR da arsina e o ESTADO DE OXIDAÇÃO (Nox) do arsênio no ácido arsênico, respectivamente:
Dados: massas molares (g.mol-1): S =32; Fe=56.
Se 44kg de sulfeto de ferro(II) contendo impurezas inertes produziram 6,8kg de gás sulfídrico, a porcentagem de pureza desse sulfeto é de
Dado: R = 0,082 atm.L.mol–1. K –1
Considerando o sal comum formado apenas por cloreto de sódio, a quantidade máxima de sal que pode ser utilizada por dia, por pessoa, segundo a OMS é de, aproximadamente,
Dados: massas molares (g.mol-1): Na =23; Cℓ =35,5.

O gás CO2 de um extintor de incêndio é mais denso do que o ar. À medida que o CO2 sai do extintor, resfria-se significativamente. O vapor d´água no ar é condensado pelo CO2 frio e forma uma nuvem branca.
O fator que faz com que o gás que sai do extintor seja mais denso que o ar é a
O número de moléculas desse gás lançadas por ano na atmosfera é de, aproximadamente,
I.A água pesada (D2O) é uma forma de água onde os átomos de hidrogênio são substituídos por deuterium, um isótopo do hidrogênio.
II.A densidade do gelo de D2O é quase idêntica à densidade da água líquida de D2O.
III.O ponto de fusão do gelo de água pesada (D2O) é maior que o do gelo de água comum (H2O).
É correto o que se afirma em:
Sobre massa molar e dada a distribuição hipotética a seguir, é correto afirmar:
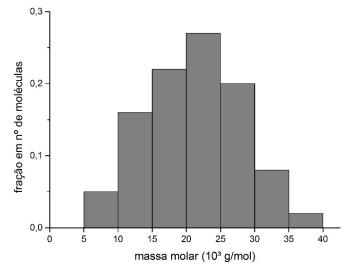
CALLISTER JR., W. D.; RETHWISCH, D. G. Ciência e engenharia de materiais: uma introdução. 8. ed. Rio de Janeiro: LTC, 2012, p. 462.
Ca5(PO4)3 F + H3PO4 + H2O HF + Ca(H2PO4)2 . H2O (I)
Em um processo industrial, partiu-se de 1 tonelada de fluorapatita fazendo-a reagir com uma quantidade suficiente de ácido fosfórico obtendo-se, ao final, 2 toneladas do produto di-hidrogenofosfato de cálcio monohidratado. Pode-se, por esses dados, prever que a pureza do mineral utilizado, em percentual, era aproximadamente igual a:
(Dados, em g/mol: Ca= 40, P=31, O=16, H=1, F=19)
(Dados em g/mol: Na= 23, O = 16, H = 1)