Questões de Concurso
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 991 questões
Considerando os cálculos estequiométricos e os assuntos correlatos, julgue o item a seguir.
A reação entre permanganato de potássio e ácido clorídrico em solução aquosa, dando como produtos cloreto de potássio, cloreto de manganês(II), cloro gasoso e água, pode ser representada pela equação química balanceada apresentada a seguir.
2 KMnO4 (aq) + 16 HCl (aq) → 2 KCl (aq) + 2 MnCl2 (aq)
+ 5 Cl2 (g) + 8 H2O (l)
Considerando os cálculos estequiométricos e os assuntos correlatos, julgue o item a seguir.
Conforme a equação genérica a seguir, a soma dos valores representados pelas letras minúsculas a + b deve ser igual à soma dos valores representados pelas letras minúsculas c + d:
a A (g) + b B (g) → c C (g) + d D (g)
Considerando os cálculos estequiométricos e os assuntos correlatos, julgue o item a seguir.
Em uma reação química, os coeficientes
estequiométricos mostram que os átomos podem ser
criados ou destruídos em uma reação balanceada.
1. pesou o objeto em uma balança analítica observando uma massa igual a 57,8499 g;
2. colocou 40,0mL de água em uma proveta;
3. mergulhou o objeto na água e observou a nova marcação do volume igual a 48,1mL;
4. pesquisou as densidades desses metais na literatura especializada:
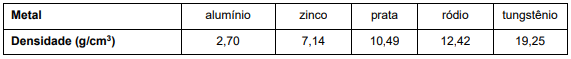
A partir desses dados, é possível concluir que o objeto é constituído de:
A química desempenha um papel crucial no processo de reciclagem, pois permite a transformação de materiais descartados em novos produtos, contribuindo para a redução do desperdício e a preservação dos recursos naturais. Um exemplo notável é o alumínio, cuja reciclagem é economicamente viável e energeticamente eficiente devido à sua capacidade de ser fundido e remodelado repetidamente sem perder suas propriedades físicas. Além disso, a síntese do alúmen (KAl(SO4)2.12H2O) a partir do alumínio reciclado destaca-se como um processo químico relevante na reciclagem desse metal. A reação dessa síntese pode ser observada abaixo e já está estequiometricamente balanceada.
𝐴𝑙(𝑠) + 𝐾𝑂𝐻(𝑎𝑞) + 2𝐻2𝑆𝑂4(𝑎𝑞) + 11𝐻2𝑂 → 𝐾𝐴𝑙(𝑆𝑂4)2 . 12𝐻2𝑂(𝑠) + 3⁄ 2 𝐻2(𝑔)
Suponha que a preparação do alúmen partiu de 2 g de lata de alumínio. Ao final do experimento obteve-se uma massa de 10 g de alúmen seco.
Dados: H: 1 u, O: 16 u, S: 32 u; Al: 27 u; K: 39 u. A massa molar do alúmen é de 474 g/mol.
Assinale a alternativa CORRETA em que indica o rendimento mássico teórico do alúmen e seu rendimento percentual experimental, respectivamente.
O ácido sulfúrico desempenha um papel fundamental na indústria química, sendo amplamente utilizado na produção de uma variedade de produtos, desde fertilizantes até produtos químicos para limpeza. A síntese do ácido sulfúrico ocorre por meio do processo de contato, no qual o dióxido de enxofre (SO2) é oxidado a trióxido de enxofre (SO3) na presença de um catalisador de óxido de vanádio. O trióxido de enxofre é então dissolvido em água para formar o ácido sulfúrico concentrado. Esse processo é essencial para atender à demanda industrial crescente por ácido sulfúrico, garantindo a produção eficiente e sustentável desse composto químico fundamental. Observe as reações abaixo que já estão estequiometricamente balanceadas.
Dados: H: 1 u, O: 16 u, S: 32 u.
Determine a quantidade de enxofre (S) necessária para produzir 1000 gramas de ácido sulfúrico (H2SO4), assumindo uma eficiência de reação de 100%. Assinale a alternativa CORRETA da massa de enxofre.
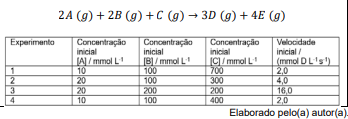
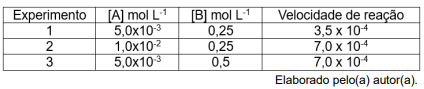
De acordo com os dados apresentados, a lei de velocidade para a reação estudada é:
Calcule a variação da entalpia (ΔH) para a reação global de formação de 0,325 ton calcita a partir de seus elementos constituintes utilizando as reações e os dados termodinâmicos fornecidos a seguir.
Use: Massa molar O = 16 g.mol-1,
I) C(s) + O2(g) ➔ CO2(g) ∆ H = -393,5 kJ mol-1
II) CaO(s) ➔ Ca(s) + 1/2O2(g) ∆H = +635,0 kJ mol-1
III) CaO(s) + CO2(g) ➔ CaCO3(s) ∆H = -178,3 kJ mol-1
Use: R = 0,082 atm . L . mol-1 K-1
Use: Massas Molares: O = 16,0 g mol-1; C = 12 g mol-1; H = 1 g mol-1; N = 14 g mol-1; Cl = 35,5 g mol-1
Massas Molares: O = 16,0 g mol-1; C = 12 g mol-1; H = 1 g mol-
2 Fe + Cl2 = 2 FeCl3
Qual é o coeficiente estequiométrico adequado a ser colocado antes de Cl2 para balancear a equação?
a PhCH 3 + b KMnO 4 + c H2SO 4 = d PhCOOH + e K2SO4 + f MnSO 4 + g H2O
(__) A soma dos coeficientes estequiométricos a + b + c = 20.
(__) A soma dos coeficientes estequiométricos a + d + f = 16.
(__) A soma dos coeficientes estequiométricos b + e + g = 23.
Assinale a alternativa que apresenta a sequência correta:
2 C6H5COOH + O2 = 14 CO2 + 6 H2O
Qual é o coeficiente estequiométrico adequado a ser colocado antes de O2 para balancear a equação?
I. Na2CO3 + HCl → NaCl + H2O + CO2
II. Al + H2SO4 → Al2(SO4)3 + H2
As equações acima não estão balanceadas; balanceie-as e assinale a alternativa que corresponde aos respectivos coeficientes estequiométricos.