Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 961 questões
A Aspirina, como é conhecida o ácido acetilsalicílico (C9H8O4), é um fármaco que apresenta propriedades antitérmicas, anti-inflamatórias e analgésicas. Esse fármaco pode ser sintetizado pela reação entre o ácido salicílico (C7H6O3) e o anidrido acético (C4H6O3), catalisada por um ácido.
A equação a seguir representa o processo de síntese da aspirina.
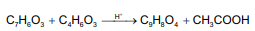
Considere, hipoteticamente, que 3 g de ácido salicílico foram misturados com 6 mL de uma solução de anidrido acético cuja densidade e grau de pureza são 1,2 g/mL e 80% m/m, respectivamente.
Se o rendimento da reação química é 100%, qual a
massa aproximada de aspirina produzida em gramas?
A densidade é o coeficiente entre o volume ocupado por um material e a massa desse material.
De acordo com o sistema internacional de unidades e as conversões para medida de volume, julgue o item a seguir.
Em uma semana de práticas laboratoriais,
foram consumidos 1.000 litros de água; ou
seja, esse volume é equivalente a 1 m3
ou
1.000 dm3
de água.
É comum, nos laboratórios químicos, efetuar a mistura de duas (ou mais) soluções de um mesmo soluto, ou a mistura de soluções cujos solutos reagem entre si. A respeito desse assunto e os cálculos relacionados, julgue o item a seguir.
Misturando-se 300 mL de HCl 0,4 M a
200 mL de NaOH 0,6 M, a solução final
apresentará excesso de um dos reagentes.
Dado: MM CuCl = 99 g.mol-1
Após analisar as afirmativas de I a V, assinale a alternativa correta:
6NH4 ClO4 (s) + 10Al (s) → 5Al2 O3 (s) + 3N2 (g) + 6HCl (g) + 9H2O (g)
Considerando que se colocou para reagir 1 kg do perclorato de amônio com 1 kg do alumínio, quanto, aproximadamente, de massa, em gramas, do óxido foi produzido na reação?
Análises químicas mostraram que um lote de carvão específico contém 2% de enxofre em massa. Quando esse carvão é queimado, o enxofre é convertido em gás dióxido de enxofre.
Considerando que nesse processo todo o dióxido de enxofre produzido da queima do carvão reagiu completamente com óxido de cálcio produzindo 2 mil toneladas de sulfito de cálcio, é correto afirmar que a massa aproximada, em toneladas, de carvão queimado é:
Um dos processos químicos industriais mais importantes que existem é a produção de amônia a partir de hidrogênio e nitrogênio. Este processo ocorre a altas temperaturas e pressões (>450ºC e 200 atm) e pode ser representado pela seguinte reação: N2(g) + 3 H2(g) → 2 NH3(g). Calcule a quantidade (em gramas) de N2 necessário para conseguir 5,0 mol de NH3 e a quantidade (em mol) de NH3 obtido a partir de 2,0 mol H2 . Dados: 1 mol de N = 14 g, 1 mol de H = 1 g.
Assinale a alternativa que possui ambas respostas corretas.
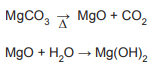
A massa de Mg(OH)2 obtida a partir de uma massa inicial de MgCO3 igual a 2,1 g é
Dados M(Mg) = 24,3 g mol-1 M(C) = 12,0 g mol-1 M(O) = 16,0 g mol-1 M(H) = 1,0 g mol-1
Qual é o volume, em litros, ocupado por 54 kg de gasolina pura?
Considere a reação ácido-base de Lewis entre gás clorídrico e amônia:
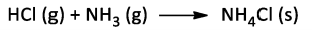
Considerando 100% de rendimento, calcule o volume mínimo da mistura equimolar dos reagentes, a 27ºC e 1 atm, de
modo que seja possível a obtenção de 10,7g do produto. Massas molares (g/mol): H = 1; N = 14; Cl = 35,5.
Um acidente ambiental provocou a contaminação das águas de um estuário com chumbo. Uma amostra de 200,0 mL foi coletada para análise e todo o chumbo foi precipitado na forma de PbSO4 devido ao tratamento da amostra com ácido sulfúrico. Sabendo que a massa obtida de PbSO4 foi 6,06 mg, qual é a concentração de chumbo na amostra, em mg/L?
Massas molares (g/mol): O = 16; S = 32; Pb = 207.
O ácido monoprótico, representado por HX, é misturado com excesso de Ba(OH)2 , reagindo segundo a equação abaixo.

Foram obtidos 15,00 g do produto BaX2 que foram quantitativamente reagidos com exatamente 59,00 mL de uma solução aquosa de ácido sulfúrico 1,00 mol L-1 , como mostrado na equação abaixo.
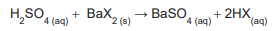
A partir dos dados do experimento, calculou-se a massa
molar de HX, em g mol -1
, e concluiu-se que era de 



