Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 961 questões
A pílula anticoncepcional é fabricada com diferentes tipos de hormônios. Os mais usuais são o estrogênio e a progesterona. Nas pílulas de baixa dosagem hormonal é encontrado o etinilestradiol (C20H24O2), derivado sintético do estrogênio, em diferentes proporções. Um laboratório recebeu uma amostra contendo 2035 g de etinilestradiol contaminado e verificou que o grau de pureza do hormônio era de 80%. Como a purificação da amostra era inviável, foi constatada a necessidade de descartar todo o material recebido. O número de moles do hormônio que foram encaminhados para incineração é de:
Dados: H = 1 g/mol; C = 12 g/mol; O = 16 g/mol
Uma amostra que pesa 1,55 g contém fósforo na forma de dihidrogenofosfato de sódio (NaH2PO4). Após receber tratamento adequado, a amostra foi misturada com solução de íons magnésio (Mg2+) e com solução de íons amônio, obtendo-se um precipitado de fosfato duplo de magnésio e amônio, conforme a reação a seguir:
H2PO4- + Mg2+ + NH4+ + 6H2O → MgNH4PO4 ˑ 6H2O(s) + 2H+
No procedimento de análise, o precipitado, após lavado e seco, foi decomposto a pirofosfato de magnésio (Mg2P2O7) conforme a reação abaixo.
2MgNH4PO4 ˑ 6H2O(s) 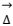 Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Mg2P2O7(s) + 2NH3(g) + 13H2O(g)
Se a massa de pirofosfato de magnésio obtida foi de 1,11 g, o teor de fósforo na amostra é
A calcinação do sulfato de bário, em condições de reagir, fornece duas espécies, sendo uma delas um óxido gasoso de enxofre e a outra um óxido básico. A massa, em gramas, do referido gás, obtida a partir de 0,5 mol de sulfato de bário, é de:
Dado: Ba= 137,5.
A calcinação do dicromato de amônio produz três espécies químicas, entre elas gás nitrogênio e água. A massa, em gramas, de gás nitrogênio produzida a partir da calcinação de 126g do sal citado é:
Dados: Cr=52,0 e N= 14,0.
O carvão é uma espécie química que contém carbono puro e impurezas. Tendo como base tal informação, o volume, em litros, de gás carbônico obtido pela queima de 1 kg de carvão a 96% é:
Dado: C=12.
O minério chamado “blenda” é utilizado na obtenção de zinco. Sabendo-se que uma amostra de tal minério contém 90% de pureza, a massa, em gramas, de zinco que pode ser obtida a partir de 200g de blenda é de:
Dados: Zn=65 e S=32.
O clorato de potássio é obtido pela passagem de cloro em uma solução de hidróxido de sódio, produzindo-se também cloreto de potássio e água. Uma solução assim obtida foi evaporada à secura e aquecida para a decomposição do clorato. Sabendo-se que o resíduo total do cloreto de potássio pesou 298g, a massa, em gramas, do hidróxido de potássio utilizada é de:
Dados: K=39; Cl=35,5; O=16; H=1.
A calcinação de 1,0 mol de sulfato de amônio formará quatro substâncias, sendo uma delas o gás amônia. A massa de gás amônia, em gramas, produzida na referida reação será de:
Dados: Ca=40; S=32; O=16 e H=1.
Dados: K=39 e Cl=35,5.
Dados: K=39; H= 1, O=16 e S=32.
Para determinar o teor de prata em uma liga, realizou-se um procedimento de gravimetria. Tal procedimento partiu de uma amostra da liga de 5g à qual foi submetida a abertura com ácido nítrico seguido de tratamento com solução de cloreto de sódio. Ao fim do procedimento foram obtidos 4,3g de precipitado. A partir dessas informações pode-se constatar que o teor de prata na liga analisada era, aproximadamente, de:
Considere as seguintes massas molares em g. mol-1: Na = 23, Cℓ = 35, Ag = 108).
Uma amostra de solo com volume de 3,2 litros pesou 5,1 kg. Os ensaios de laboratório para a determinação da umidade natural, do peso específico das partículas e do grau de compacidade do material forneceram os seguintes dados:
Umidade:
peso úmido = 7,65g — 5,05g
peso seco = 6,55g — 4,32g
O teor de umidade da amostra, em %, é:
Julgue o item seguinte, relativo a grandeza, unidade de medida e soluções.
Considere‐se que uma alíquota de 5 mL de uma solução aquosa de cloreto de potássio com concentração igual a 1 mol L−1 seja transportada para um balão volumétrico de 1.000 mL. Nesse caso, após ser realizada a diluição dessa alíquota até o preenchimento do balão volumétrico, a nova concentração dessa solução será igual a 0,02 mol L−1.
Julgue o item seguinte, relativo a grandeza, unidade de medida e soluções.
Titulação é a análise da composição pela medida do volume de uma solução (titulante) necessário para reagir com um determinado volume de outra solução. Em uma titulação ácido‐base, um ácido é titulado com uma base.
A titulação é realizada com a adição gradativa de uma
solução de um reagente à solução de outro, até que o ponto de equivalência seja assinalado por uma mudança de cor ou outra indicação.
Julgue o item seguinte, relativo a grandeza, unidade de medida e soluções.
Considerando‐se que as massas molares dos átomos de hidrogênio e de oxigênio, respectivamente, sejam iguais a 1 g mol−1 e 16 g mol−1, a quantidade de matéria, em mol, presente em 1 m3 de água (1.000 kg) será maior que 5,0 × 103 mol.
Julgue o item seguinte, relativo a grandeza, unidade de medida e soluções.
O número aproximado de 6,02 × 1023 é importante para a química; é o número de átomos de qualquer elemento que apresente uma massa, em gramas, numericamente igual à massa atômica, em unidade de massa atômica.