Questões de Concurso
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 991 questões
Um estudante misturou 50 mL de solução aquosa de ácido sulfúrico 0,10 mol/L com 50 mL de solução aquosa de hidróxido de sódio 0,40 mol/L e introduziu algumas gotas de fenolftaleina. O processo pode ser representado pela equação não balanceada:
H2SO4(aq) + NaOH(aq) → Na2SO4(aq) + H2O(l)
Ao término da reação, pode-se concluir acertadamente queUm estudante fez reagir uma quantidade suficiente de nitrato de prata com 2.000 mL de solução de cloreto de bário 0,300 M, de acordo com a seguinte equação:
2 AgNO3(aq) + BaCl2(aq) → 2 AgCl(s) + Ba(NO3)2(aq) .Assim, é correto afirmar que a massa de cloreto de prata precipitada é aproximadamente
4 NH3(g) + 5 O2(g) → 4 NO(g) + 6 H2O(g) 2 NO(g) + O2(g) → 2 NO2(g) 3 NO2(g) + H2O(l) → 2HNO3(aq) + NO(g)
Supondo-se que o rendimento esperado nesse processo seja de 90% e que a amônia utilizada apresente 20% de impurezas, a massa de amônia, em toneladas, necessária para obtenção de 6,3 t de ácido nítrico será de, aproximadamente:


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A massa molar da molécula de luminol é superior a
176,0 g/mol.


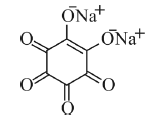
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir.
Considere que na reação do bário com o rodizonato de sódio, mostrado na figura a seguir, haja apenas troca de cátions para gerar a coloração laranja. Nessa situação, para formar o composto rodizonato de bário, serão necessários mais de 1.000 μg de rodizonato de sódio para reagir totalmente com 1.306,5 μg de nitrato de bário.
C6H12O6(aq) → C2H6O(aq) + CO2(g)
(Massas molares (g mol-1 ): C = 12; H = 1; O = 16)
Qual é a massa, em gramas, de CO2 produzida quando 0,400 mol de glicose reage dessa maneira?
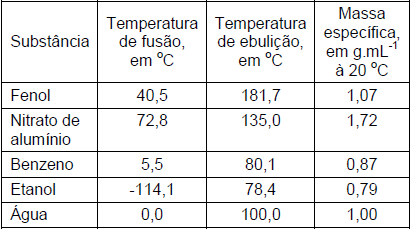
Sobre essas substâncias, quando submetidas à pressão de 1 atmosfera, são feitas as seguintes afirmativas:
I. Quando aquecido à temperatura de 50 oC, o fenol se encontrará no estado líquido. II. O nitrato de alumínio é um sólido mesmo quando se encontra na temperatura de 70 oC. III. A massa, em gramas, de 1 L de benzeno será a mesma de 1 L de fenol. IV. A massa da mistura de 150 mL de água com 150 mL de etanol será 300 g.
Assinale a alternativa em que todas as afirmativas estão CORRETAS:
Texto para a questão.
A exploração, em sala de aula, do tema sabões e detergentes permite diferentes enfoques e técnicas de ensino, que promovem o pensamento crítico dos alunos por se tratar de um tema organizador relacionado a seu cotidiano. Tal proposta valoriza o aluno como indivíduo pensante, promovendo o papel do professor a mediador e orientador do processo educacional. Isso valoriza o papel desempenhado pela escola e contribui com o processo de aprendizagem da química, favorecendo, encorajando e sustentando a autoconstrução e o desenvolvimento do conhecimento por parte dos alunos. Nesse contexto, a equação genérica seguinte descreve o processo de saponificação, em que R corresponde a cadeias iguais ou diferentes, contendo entre 12 e 18 átomos de carbono.

Com base nesse caso hipotético, assinale a alternativa que apresenta o valor mais próximo da massa de NaOH necessária para essa reação.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de água produzido, a energia liberada é de
109 kcal.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, a quantidade de O2 consumida é de
48 g.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, são liberados 88 g de CO2.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
A massa de 1 mol de etanol é 46 g.
Um Profissional Técnico de Laboratório precisava determinar o teor de cinzas de uma amostra de biodiesel e seguiu uma metodologia descrita por Araújo et al, 2008. Para isso, ele utilizou cadinhos previamente tarados via aquecimento em mufla e pesagem. Nos cadinhos foram adicionados uma determinada quantidade de biodiesel. A seguir, a amostra foi submetida a aquecimento até a temperatura de combustão e após a queima foi aquecida a uma temperatura de 800°C por 2 horas. Em seguida foi adicionada uma solução aquosa de ácido sulfúrico (1:1) e a amostra foi novamente submetida ao processo de aquecimento (800°C por 2 horas). O Profissional Técnico aguardou o resfriamento e efetuou a pesagem dos cadinhos. O procedimento de aquecimento foi repetido até observação de peso constante.
ARAÚJO, A. M. M.; EVANGELISTA, J. P. C.; GOMES, A. F.; SOUZA, L. D.; MATIAS, L.G. O. Análises das cinzas sulfatadas do biodiesel produzido a partir da matéria-prima extraída do RN. In: 48º Congresso Brasileiro de Química – Química na Proteção ao Meio Ambiente e à Saúde. Rio de Janeiro, 2008.
Acerca da situação hipotética descrita acima,
assinale a alternativa correta.
6 H+ + 5 H2C2O4 + 2 MnO4- → 10 CO2 + 2 Mn2+ + 8 H2O
determine a porcentagem em massa de carbonato de cálcio na referida mistura de cloretos.
Vários compostos orgânicos com átomos de halogênios diferentes de cloro foram ou são usados comercialmente. Como exemplo, os fréons são utilizados como propelentes de aerossóis e como gases de refrigerante, o 1,2-dibrometano (EBD) é utilizado como inseticida em grãos, o ácido 2,4-diclorofenoxiacético é utilizado como herbicida. Sabendo qual a função orgânica e como ela se caracteriza no composto, podemos compreender qual uso o composto poderá ter.
Analise, a seguir, a tabela de compostos e alguns usos específicos.

