Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 961 questões
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

A análise volumétrica de uma determinada amostra de um ácido diprótico, com NaOH 0,100 mol L-1 , foi realizada usando-se o seguinte procedimento: inicialmente, coletou-se uma alíquota da amostra com o instrumento (1) indicado na figura ao lado; após a devida aferição de volume, a alíquota foi transferida para o instrumento (2); em seguida, o volume do instrumento (2) foi aferido com água destilada; posteriormente, uma alíquota da solução obtida foi coletada com o instrumento (3), devidamente aferido, e transferida para o instrumento (4), onde adicionou-se um indicador apropriado; ao acionar o instrumento (5), observou-se a mudança da cor da solução titulada após a adição do volume indicado pela seta.
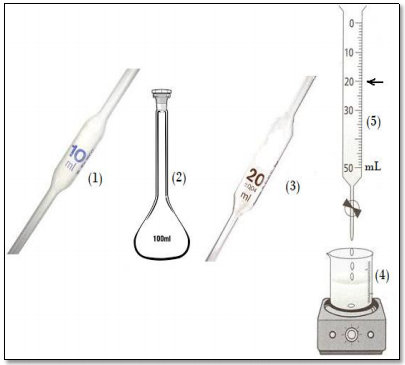
Para a reação envolvida na titulação, devidamente balanceada, o resultado da soma dos coeficientes estequiométricos é
O laboratório que está sujeito à norma na questão anterior é um gerador contínuo de resíduos de mercúrio. O tratamento adequado desses resíduos consiste na sua acidificação com ácido nítrico seguido da adição de tioacetamida (CH3SNH2). Esse último sofre decomposição, gerando íons sulfeto em meio ácido.
Dados: M (g.mol-1 ): Hg = 200; S = 32; N = 14; H = 1; KPS: HgS = 2 x 10-53 .
Uma bombona de 20L contém um resíduo de mercúrio em concentração de 0,1 mol.L-1 . Qual é a massa (em gramas) mínima necessária de tioacetamida para tratar esse resíduo?
Num experimento químico eram necessários 60 gramas de iodeto de cobre (I), mas este reagente estava em falta. Assim a solução do problema era fabricá-lo de acordo com a reação química a seguir:
KI(aq) + CuSO4(aq) → I2(s) + K2SO4(aq) + CuI(s)
Quantos gramas de sulfato de cobre (II) serão necessários para formar a quantidade exata de iodeto
de cobre (I)?
No processo de obtenção de ferro a partir da hematita, Fe2O3 (s), considere a equação não balanceada:
Fe2O3 (s) + C (s) → Fe (s) + CO (g)
Utilizando-se 4,8 t de minério e admitindo-se um rendimento de 70% na reação, a quantidade de ferro produzida será de:
Dados: Fe = 56; O= 16; C= 12 (valores expressos em g/mol)
O hipoclorito de sódio, conhecido popularmente como água sanitária, tem propriedades bactericida e alvejante. Para sua fabricação, reage-se gás cloro com soda cáustica:
Cl2 (g) + 2 NaOH (aq) → NaCl (aq) + NaClO (aq) + H2O (l)
A massa de NaOH (aq) necessária para obter 298 kg de hipoclorito de sódio é:
Dados: H = 1; O = 16; Na = 23; Cl = 35,5 (valores expressos em g/mol)
Em uma ação policial para combate ao tráfico de substâncias psicoativas (“drogas de abuso”), foram apreendidos 10.000 (dez mil) tubos plásticos, de formato cônico, do tipo eppendorf, com volume de 1,5 mL, cujo interior apresentava sólido pulverizado de coloração bege, que preenchia um volume de 1,0 mL de cada um dos tubos. Durante o exame preliminar do material, foram feitas as seguintes observações:
• Todos os tubos apresentavam as mesmas dimensões e foram preenchidos com o mesmo volume, massa e tipo de pó.
• A massa do material apreendido (correspondente à soma da massa dos tubos e do pó contido em todos os tubos) era de 15.000g (quinze mil gramas).
• A massa de 10 tubos, obtida após a remoção completa do pó de cada um deles, era de 10,0g.
Além disso, por meio de técnicas de amostragem e analíticas, determinou-se que o pó, em todos os tubos, apresentava um teor de cocaína de 5,0%.
Em uma ação policial para combate ao tráfico de substâncias psicoativas (“drogas de abuso”), foram apreendidos 10.000 (dez mil) tubos plásticos, de formato cônico, do tipo eppendorf, com volume de 1,5 mL, cujo interior apresentava sólido pulverizado de coloração bege, que preenchia um volume de 1,0 mL de cada um dos tubos. Durante o exame preliminar do material, foram feitas as seguintes observações:
• Todos os tubos apresentavam as mesmas dimensões e foram preenchidos com o mesmo volume, massa e tipo de pó.
• A massa do material apreendido (correspondente à soma da massa dos tubos e do pó contido em todos os tubos) era de 15.000g (quinze mil gramas).
• A massa de 10 tubos, obtida após a remoção completa do pó de cada um deles, era de 10,0g.
Além disso, por meio de técnicas de amostragem e analíticas, determinou-se que o pó, em todos os tubos, apresentava um teor de cocaína de 5,0%.
O carbureto (carbeto de cálcio) é um sólido empregado tanto para iluminação quanto para processos de solda, devido à formação de acetileno (C2H2), quando da sua exposição à água, de acordo com a equação não balanceada:
CaC2(s) + H2O(l) → Ca(OH)2(aq) + C2H2(g)
Uma amostra de 10g de um sólido contendo 40,0% de carbeto de cálcio foi colocada em 200g de água, produzindo acetileno. Considere que as impurezas são imiscíveis em água e não interferem na produção de acetileno e que, na reação, todo o carbureto foi convertido em acetileno. Com base no exposto, a quantidade mais próxima de acetileno produzida e o pH do meio aquoso após a reação serão: Dados:massas molares: H: 1g/mol; C: 12g/mol; O: 16g/mol; Ca:40g/mol
solubilidade do Ca(OH)2(aq) = 1,2g/L
Uma determinada estação de tratamento faz a desinfecção de água residual com HOCl e, após o processo, determinou-se que o teor total de HClO restante (expresso como Cl2) é de 2 mg L-1. Antes da liberação desta água para o ambiente, é necessário eliminar-se o excesso de HClO, o que é feito reduzindo-o a cloreto pela adição de uma solução de bissulfito de sódio (NaHSO3) 0,1 mol L-1. Se o fluxo de água residual a ser tratada é de 2 m3 s-1, a taxa da solução de bissulfito de sódio (em L s-1) que deve ser adicionada ao fluxo de água residual para uma completa inativação do cloro é de aproximadamente
Observação:
Considere que o fluxo da solução de NaHSO3 é desprezível em relação ao fluxo da estação.
Dados:
Massa molar (g mol-1): NaHSO3 = 104; Cl2 = 71; HOCl = 52,5.
Cl2 + 2H2O → 2HOCl + 2H+ + 2e-
2HSO3- + 2HOCl → 2SO42- + 2Cl- + 4H+
A dureza total de uma amostra de 50,0 mL de água foi determinada por titulação com EDTA de concentração 0,010 mol L-1. O volume de EDTA gasto foi de 8,00 mL. A dureza total dessa amostra de água, expressa em mg CaCO3 por litro (mg L-1 CaCO3), é de
Dado: massa molar CaCO3 = 100 g mol-1
.
Em pequenas estações de tratamento de água, dióxido de cloro, um forte agente oxidante, costuma ser preparado in situ de forma a atingir uma concentração de dióxido de cloro de 15 g L-1, conforme equação química dada abaixo:
HCl + NaClO2 → ClO2 + NaCl + H2O
Considerando-se uma estação de tratamento de 10.000 litros, o volume, em litros, de ácido clorídrico necessário para atingir a concentração de dióxido de cloro necessária é de aproximadamenteObs.: Considere que a reação ocorre estequiometricamente com rendimento de 100%. Dados: Massas molares, g mol-1: H = 1; Cl = 35,5; Na = 23; O = 16. Ácido Clorídrico: densidade = 1,2 g mL-1; Título (em massa): 37%.
Um frasco de ácido clorídrico concentrado contém 37% de HCl em massa e apresenta uma densidade de 1,20 g mL-1 . Foi transferido 5,00 mL de HCl desse frasco para um balão volumétrico de um litro e avolumado com água deionizada.
Qual o volume necessário dessa solução de HCl diluída para neutralizar 500 mL de NaOH 0,02 mol L-1 ?